Диски, подготовленные согласно пункту 2.2. помещают в стакан с коррозионной средой, в которую добавлен ингибитор различной концентрации. В качестве контроля используют стакан с неингибированной 0.25н HCl. Объём раствора в стакане составляет 100 - 150 мл. Длительность опыта составляет не менее 5-ти суток.
После окончания испытания образцы взвешивают (m), результаты заносят в таблицу 1, рассчитывают скорость коррозии. Окончательный результат представляют графически в виде диаграммы зависимости скорости коррозии от концентрации ингибитора в растворе, отмечая на этой диаграмме точку, соответствующую скорости коррозии в чистой неингибированной кислоте согласно данным контрольного опыта. Пользуясь значением этой скорости, рассчитывают величины коэффициентов Z и γ, характеризующих эффективность действия ингибиторов.
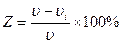
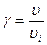
υi - скорость коррозии в присутствии ингибитора
υ - скорость коррозии в эталоне 0.25н HCl
Таблица 1.
| Образец | Масса m0, г | Масса m, г | ∆m= m0-m, г | Концентрация ингибитора, г/л | Скорость коррозии, г/сутки (υ=∆m/сутки) | Z, % | γ |
| эталон | 0.25н HCl |
На основании полученных данных построить график зависимости скорости коррозии от концентрации ингибитора υi=f(c).
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
- Понятие «коррозия».
- Электрохимическая коррозия, виды электрохимической коррозии. Кислотная коррозия.
- Механизм кислотной коррозии железа и сталей.
- Основные способы защиты стали от коррозии.
- Меры предотвращения коррозии стали.
- Ингибиторы коррозии, основные способы применения ингибиторной защиты.
- Катодные, анодные и смешанные ингибиторы. Механизм их действия.
- Основные характеристики эффективности действия ингибиторов.
- Факторы, влияющие на эффективность действия ингибиторов.
 2015-07-14
2015-07-14 394
394








