Важнейшие восстановители и окислители
| Восстановители | Окислители |
| Металлы, водород, уголь Оксид углерода (II) CO Сероводород H2S, оксид серы (IV) SO2, сернистая кислота H2SO3 и ее соли Иодоводородная кислота HI, бромоводородная кислотаHBr, соляная кислота HCl Хлорид олова (II) SnCl2, сульфат железа (II) FeSO4, сульфат марганца (II) MnSO4, сульфат хрома (III)Cr2(SO4)3 Азотистая кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота (II) NO Фосфористая кислота H3PO3 Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза Катод при электролизе | Галогены Перманганат калия KMnO4, манганат калия K2MnO4, оксид марганца (IV) MnO2 Дихромат калия K2Cr2O7, хромат калия K2CrO4 Азотная кислота HNO3 Кислород O2, озон О3, пероксид водорода Н2О2 Серная кислота H2SO4 (конц.), селеновая кислотаH2SeO4 Оксид меди (II) CuO, оксид серебра (I) Ag2O, оксид свинца (IV) PbO2 Ионы благородных металлов (Ag+, Au3+ и др.) Хлорид железа (III) FeCl3 Гипохлориты, хлораты и перхлораты Царская водка, смесь концентрированной азотной и плавиковой кислот Анод при электролизе |
Составление овр
Метод электронного балланса
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции.Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах.
Пример 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
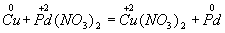
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь - восстановитель. Ион палладия, присоединяя два электрона,изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями
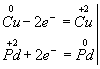
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd2+ + 2NO3- = Cu2+ + 2NO3- + Рd
И после сокращения одинаковых ионов получим
Cu + Pd2+ = Cu2+ + Pd
Пример 2. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции влабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
НCl + МnО2 → Сl2 + MnСl2 + Н2О
Покажем изменение степеней окисления атомов до и после реакции:
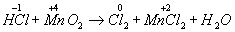
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl - восстановитель, MnО2 — окислитель.Составляем электронные уравнения:
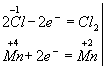
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НСl + MnO2 → Сl2 + MnСl2 + Н2О
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая,что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2моль. Окончательное уравнение имеет вид
4НCl + МnО2 = Сl2 + MnСl2 + 2Н2О
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н+ + 4Сl- + МnО2 = Сl2 + Мn2+ + 2Сl- + 2Н2О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н+ + 2Cl- + MnO2 = Сl2 + Mn2+ + 2Н2О
Пример 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции - формулы исходных и полученных веществ:
Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О
Затем покажем изменение степеней окисления атомов до и после реакции:
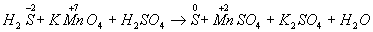
Изменяются степени окисления у атомов серы и марганца (Н2S - восстановитель, КМnО4 - окислитель). Составляем электронные уравнения, т.е.изображаем процессы отдачи и присоединения электронов:
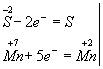
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2S и 2моль КМnО4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1моль К2SО4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2.4 + 3.4 = 20 и в правой части 2.4 + 4 + 8 = 20.
Переписываем уравнение в ионной форме:
5Н2S + 2MnO4- + 6H+ = 5S + 2Мn2+ + 8Н2О
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
 2015-08-13
2015-08-13 938
938







