Лабораторная работа № 2
Адсорбция
Цель работы: Исследование явления адсорбции уксусной кислоты на активированном угле.
Принадлежности к работе: 6 колб на 100 мл; бюретка для титрования; пипетки на 10 и 5 мл; мерный цилиндр на 50 мл; ступка фарфоровая с пестиком; штатив; вата; 4 г активированного угля; фенолфталеин; 0,4 н. раствор СН3СООН; 0,1 н. раствор NaOH.
Теоретическая часть
Адсорбция – это явление концентрирования вещества на поверхности раздела фаз. Адсорбент– вещество, на поверхности которого происходит адсорбция. Адсорбат (адсорбтив) – это вещество, адсорбирующееся на поверхности адсорбента.
Физическая адсорбция обусловлена силами Ван-дер-Ваальса, возникающими между частицами адсорбата и адсорбента. Она обратима и уменьшается с ростом температуры. Химическая адсорбция (хемосорбция) обусловлена химическими силами. Она необратима и увеличивается с ростом температуры.
Адсорбция бывает мономолекулярная (на поверхности раздела образуется слой адсорбата толщиной в одну молекулу) и полимолекулярная (на поверхности раздела образуется полимолекулярный слой адсорбата). Адсорбция бывает нелокализованная – молекулы адсорбата могут свободно перемещаться вдоль поверхности адсорбента. Локализованная адсорбция – это химическая или сильная физическая адсорбция, при которой адсорбированная молекула прочно связана с адсорбентом и не может перемещаться вдоль поверхности, что встречается очень редко.
Величина адсорбции Г (гамма) выражается в моль/г адсорбента или в моль/1 м2 (см2) его поверхности.Зависимость величины адсорбции Г от концентрации или давления адсорбата в газовой фазе при Т = const выражается уравнением изотермы адсорбции.
При малых давлениях (концентрациях) адсорбата величина Г пропорциональна давлению или концентрации адсорбата, согласно уравнению изотермы адсорбции Генри:
Г=kрили Г=kС.
Часто величину адсорбции характеризуют степенью заполнения поверхности данным адсорбатомq.q = Г, т. е. заполнение поверхности пропорционально давлению адсорбата в газовой фазе Р или его концентрации С в «области Генри», т. е. в области небольших р или С.
Мономолекулярная адсорбция описывается уравнением изотермы адсорбции Ленгмюра:
Г = 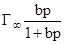 ,
,
где Г - величина адсорбции газа, Г¥- максимально возможное количество адсорбированного вещества при образовании мономолекулярного слоя адсорбата, т. е. предельная удельная адсорбция (единицы измерения такие же как у Г), b – константа адсорбционного равновесия, р - равновесное давление газа. Уравнение, выраженное через степень заполнения q, имеет вид
q = 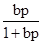 ; q = Г/Г¥.
; q = Г/Г¥.
Изотерма адсорбции Ленгмюра может быть выражена через объем поглощенного газа: 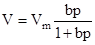 ,где V - объем адсорбированного газа, л/г, м3/г, см3/г; Vm - максимально возможный объем адсорбата, полностью покрывающего поверхность 1 г адсорбента.
,где V - объем адсорбированного газа, л/г, м3/г, см3/г; Vm - максимально возможный объем адсорбата, полностью покрывающего поверхность 1 г адсорбента.
Площадь поверхности 1 г адсорбента Syд – удельная поверхность:
Sуд = Г¥NAS0, S0 – площадь, которую на поверхности адсорбента занимает 1 молекула адсорбата.
Адсорбция из раствора описывается уравнением Ленгмюра видаГ = 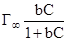 , где
, где
С – равновесная концентрация адсорбированного вещества в растворе, моль/м3.
Уравнение Ленгмюра можно привести к линейному виду, что позволит графически определить его константы b и Г¥. Для этого р или С делят на каждую часть уравнения. При этом получают уравнение: 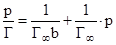 .
.
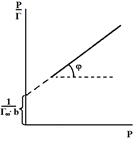
| Рис. 1. Зависимость 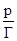 = f(р) к уравнению Ленгмюра.
Отрезок, отсекаемый на оси ординат, равен = f(р) к уравнению Ленгмюра.
Отрезок, отсекаемый на оси ординат, равен 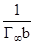 .
ctgj=Г¥. .
ctgj=Г¥.
|
Если использовать объем поглощенного газа, уравнение принимает вид:
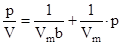 .
.
Адсорбция из раствора описывается уравнением: 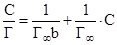 .
.
Для средних заполнений поверхности адсорбента используют уравнение изотермы Фрейндлиха:
Г = 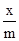 =kрa или Г =
=kрa или Г = 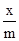 = kСa,
= kСa,
где х - количество адсорбированного вещества, моль, m - масса адсорбента в граммах, k и a - константы.aназывается степенью приближения изотермы к прямой. Константы уравнения Фрейндлиха определяются графически после логарифмирования:
lgГ = lgk + algC.
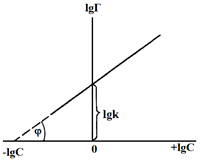
| Рис. 2. Зависимость lg Г = f(lgC) к уравнению Фрейндлиха. tgj = a; отрезок, отсекаемый на оси ординат равен lgk. |
Адсорбция на границе жидкость/пар описывается уравнением изотермы адсорбции Гиббса:Г = 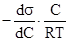 ,где С – концентрация поверхностно-активного вещества (ПАВ) в растворе,
,где С – концентрация поверхностно-активного вещества (ПАВ) в растворе, 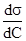 – изменение поверхностного натяжения раствора на единицу концентрации ПАВ, которое определяется графически из кривой зависимости поверхностного натяжения раствора ПАВ от его концентрации. ПАВ – это органические кислоты, спирты, амины, кетоны, мыла и другие моющие средства. Для структуры их молекул характерно наличие полярной группы и неполярного углеводородного радикала, поэтому молекулы при внесении их в воду стремятся выйти на границу раздела вода/пар, где каждая из указанных частей молекул ориентируется соответственно своей природе: полярная группа - в сторону полярной среды (в воду), неполярная - в воздух (рис. 3).
– изменение поверхностного натяжения раствора на единицу концентрации ПАВ, которое определяется графически из кривой зависимости поверхностного натяжения раствора ПАВ от его концентрации. ПАВ – это органические кислоты, спирты, амины, кетоны, мыла и другие моющие средства. Для структуры их молекул характерно наличие полярной группы и неполярного углеводородного радикала, поэтому молекулы при внесении их в воду стремятся выйти на границу раздела вода/пар, где каждая из указанных частей молекул ориентируется соответственно своей природе: полярная группа - в сторону полярной среды (в воду), неполярная - в воздух (рис. 3).
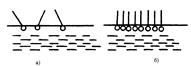
| Рис. 3. Ориентация ПАВ на границе раздела водный раствор/воздух: а - ненасыщенный слой; б - насыщенный мономолекулярный слой ПАВ. |
Накопление ПАВ на поверхности раздела фаз вызывает понижение поверхностного натяжения s раствора. Это понижение sсвязано с концентрацией ПАВ в растворе в соответствии с уравнением Шишковского:
s0 – s = a ln(l + bC),
где s0 и s - поверхностное натяжение растворителя и раствора соответственно, а и b - константы, причем «b» имеет то же значение, что и в уравнении изотермы Ленгмюра, характеризуя поверхностную активность вещества. Константа «а» связана с константой Г¥ уравнения Ленгмюра соотношением
а = Г¥RT
и имеет постоянное значение для всего гомологического ряда ПАВ, т. к. предельная адсорбция Г¥ при образовании мономолекулярного слоя определяется площадью поперечного сечения полярной группы ПАВ, которая одинакова во всем гомологическом ряду.
Правило Траубе: поверхностная активность, выражаемая как -(ds/dC), увеличивается в 3 - 3,5 раза при удлинении углеводородной цепи ПАВ на одно звено (группа СН2).
Для ПАВ ds/dC< 0, Г > 0, адсорбция положительная.
Вещества, повышающие s, называются поверхностно неактивными веществами или поверхностно-инактивными веществами(ПНВ или ПИВ). Их концентрация у поверхности раздела фаз меньше, чем в объеме. Для ПИВds/dC> 0, Г < 0, адсорбция отрицательная.
Масса вещества, адсорбированного на 1 м2 поверхности, равна:m = Г¥М, где М – молярная масса адсорбированного вещества, г/моль.С другой стороны, величину m можно выразить как массу вещества, находящегося в объеме адсорбционного слоя с площадью 1 м2 и толщиной h, м:m = hr, где r - плотность адсорбата, г/м3.
Таким образом, Г¥М = hr, откуда h= 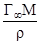 .
.
Для полимолекулярной только физической адсорбции на твердом адсорбенте Брунауэр, Эммет и Теллер вывели уравнение изотермы адсорбции БЭТ:
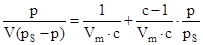 ,
,
где V - общий объем адсорбированного газа, Vm- объем адсорбированного газа, соответствующий мономолекулярному покрытию всей поверхности адсорбента, р – равновесное давление адсорбированного газа, рs – давление насыщенного пара, с - константа при данной температуре.
|
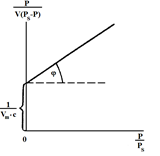
Рис. 4. Линейная зависимость к уравнению адсорбции БЭТ.
tgj = 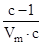 . На вертикальной оси отсекается отрезок . На вертикальной оси отсекается отрезок 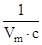 .
Для пересчета Vm на Г¥ используют формулу:Г¥ = .
Для пересчета Vm на Г¥ используют формулу:Г¥ = 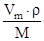 . .
|
 2015-08-12
2015-08-12 311
311







