 Зависимость константы равновесия от температуры. Обычно константа равновесия изменяется с изменением температуры. Если в ходе реакции выделяется тепло, то с повышением температуры реакция замедляется и K уменьшается. Напротив, когда тепло в ходе реакции поглощается, константа равновесия с повышением температуры увеличивается. Температурная зависимость константы равновесия выражается в виде
Зависимость константы равновесия от температуры. Обычно константа равновесия изменяется с изменением температуры. Если в ходе реакции выделяется тепло, то с повышением температуры реакция замедляется и K уменьшается. Напротив, когда тепло в ходе реакции поглощается, константа равновесия с повышением температуры увеличивается. Температурная зависимость константы равновесия выражается в виде
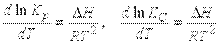
где Н – теплота химического процесса (т.е. теплота химической реакции, теплота растворения и т.д.).
Интегрирование от Т1 до Т2 дает
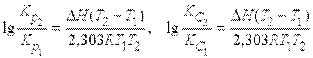
Отсюда, зная значение K при двух температурах, можно найтиН. Или, если известны Kр либо KС при одной температуре иН, можно определить Kр или KС при другой температуре.
Влияние температуры на скорость химической реакции. Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций):
|
|
|
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза: 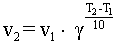
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
где γ - температурный коэффициент, принимающий значения от 2 до 4.
С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц a, зависящую от температуры: - a = exp(-E/RT). и вывел уравнение Аррениуса для константы скорости реакции:
k = koe-E/RT ,где ko и E dзависят от природы реагентов. Е - это энергия, которую надо придать молекулам, чтобы они вступили во взаимодействие, называемая энергией активации.
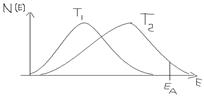 | Энергия активации (Е) элементарной реакции – это значение кинетической энергии в распределении молекул по энергиям, при которой происходит химическое взаимодействие (энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния реакционной системы в другое). |
Для обратимой реакции разность энергий активации прямой (Е1) и обратной (Е2) реакций равна тепловому эффекту реакции. Уравнение Аррениуса представляют в виде линейной зависимости логарифма константы скорости от обратной температуры: ln k = f (1/T).
Тепловой эффект химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция.
В общем случае эта теплота расходуется на изменение внутренней энергии системы ΔU и на совершение работы против внешних сил W: Q = ΔU + W (согласно закону сохранения энергии).
|
|
|
Предположим, что система за счет поглощения теплоты Q переходит из начального состояния 1 в конечное состояние 2, тогда: ΔU = U2- U1. Для химических реакций под работой против внешних сил подразумевается работа против внешнего давления. Обычно она совершается за счет расширения системы, например, при выделении газа. Работа против внешнего давления равна произведению давления р на изменение объема системы ΔV при переходе ее из состояния 1 в состояние 2: W = р ΔV, ΔV = V2 — V1, W = р(V2 — V1).
При изохорном процессе (V = const), поскольку изменения объема системы не происходит, W = 0. Тогда переходу системы из состояния 1 в состояние 2 отвечает равенство: Qv = U2 — U1 = ΔU.
При изобарном процессе (р = cost, характерно для подавляющего большинства химических реакций) тепловой эффект Qp равен Qp = Δ U + р ΔV, Qp = (U2 — U1) + p(V2 — V1)
или Q = (U2 + p U2)-(U1 + pU1).
Закон сохранения энергии называют также первым законом термодинамики.
Величину U + pV называют энтальпией. Таким образом, если при изохорном процессе энергетический эффект реакции равен изменению внутренней энергии системы, то в случае изобарного процесса он равен изменению энтальпии системы.
 2015-08-12
2015-08-12 2792
2792
