Химические реакторы для проведения различных процессов отличаются друг от друга по конструктивным особенностям, размеру, внешнему виду. Однако, несмотря на существующие различия, можно выделить общие признаки классификации реакторов, облегчающие систематизацию сведений о них, составление математического описания и выбор метода расчета.
Наиболее употребимы следующие признаки классификации химических реакторов и режимов их работы; 1) режим движения реакционной среды (гидродинамическая обстановка в реакторе); 2) условия теплообмена в реакторе; 3) фазовый состав реакционной смеси; 4) способ организации процесса; 5) характер изменения параметров процесса во времени; 6) конструктивные характеристики.
Классификация по условиям теплообмена. Протекающие в реакторах химические реакции сопровождаются тепловыми эффектами. Вследствие выделения или поглощения теплоты изменяется температура и возникает разность температур между реактором и окружающей средой, а в определенных случаях температурный градиент внутри реактора. Разность температур ДТ является движущей силой теплообмена.
При отсутствии теплообмена с окружающей средой химический реактор является адиабатическим. В нем вся теплота, выделяющаяся или поглощающаяся в результате химических процессов, расходуется на «внутренний» теплообмен - на нагрев или охлаждение реакционной смеси.
Реактор называется изотермическим, если за счет теплообмена с окружающей средой в нем обеспечивается постоянство температуры. В этом случае в любой точке реактора за счет теплообмена полностью компенсируется выделение или поглощение теплоты.
Классификация по фазовому составу реакционной смеси. Реакторы для проведения гомогенных процессов подразделяют на аппараты для 1) газофазных и 2) жидкофазных реакций. Аппараты для проведения гетерогенных процессов, в свою очередь, подразделяют на 1) газожидкостные реакторы, реакторы для процессов в системах 2) газ — твердое вещество, 3) жидкость - твердое вещество и др. Особо следует выделить реакторы для проведения гетерогенно-каталитических процессов.
Явления ускорения химических превращений в результате присутствия веществ, не принимающих видимого участия в реакции, были открыты уже на ранних этапах становления химической науки. Особый интерес к катализу проявился в период интенсивного развития промышленной химни, так как возможность ускорять химические реакции в нужном направлении без расхода энергни и по существу без расхода самого вещества катализатора придали катализу большую практическую значимость. С помощью катализа решаются задачи, стоящие перед технологией связанного азота, более 80 % нефти перерабатывается с использованием каталитических процессов, невозможно без катализаторов- осуществление большинства процессов органического синтеза. В последние годы катализаторы стали применять для решения энергетических и экологических задач, таких, как создание топливных элементов, очистка выхлопных газов автомобилей и промышленных производств и тд.
Катализаторы – это вва которые многократно вступая в промежуточное взаимод с участниками р-ии изменяют ее механизхм и увелич скор р-ии, при этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий.
Пусть протекает одностадийная р-я с энергией активации Ео
A + B = R
Ход реакции на энергетической диаграмме изображен кривой 1. В присутствии катализатора механизм реакции изменяется, она протекает через несколько последовательных стадий (кривая 2). Например первой стадией можнт быть образование промежуточного активированного комплекса Акт
А + Кт = АКт
Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта
Акт + В = RКт
Последней стадией является разложение комплекса с образованием подукта и выспобождением катализатора для нового каталитического цикла
RКт = R* + *Кт
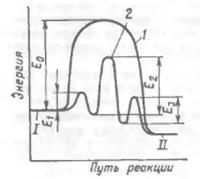 Каждая из этих последовательный стадий характеризуется своими значениями энергии активации, но как правило высота каждого из этих потенциальных барьеров ниже энергии активации Ео. Таким образом в присутствии катализатора реакция протекает по энергетически более выгодному пути что позволяет проводить процесс с большей скоростью
Каждая из этих последовательный стадий характеризуется своими значениями энергии активации, но как правило высота каждого из этих потенциальных барьеров ниже энергии активации Ео. Таким образом в присутствии катализатора реакция протекает по энергетически более выгодному пути что позволяет проводить процесс с большей скоростью
Исходное и конечное энергетические состояния реакцонной системы в присутствии катализатора и без него остаются одинаковыми, следовательно катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции.
Роль катализатора состоит лишь в изменении скорости достижении состояния равновесия. Катализатор может увеличивать скорость только тех процессов. которые разрешены термодинамически, но не может
инициировать термодинамически невозможные реакции.
Нексторые химические реакции без катализаторов практически неосуществимы, например, из-за слишком большой энергии активации. Казалось бы, что для преодоления высокого энергетического барьера можно повысить кинетическую энергию молекул, т. е. увеличить температур*. Но для многих обратимых экзотермических реакций повышение температуры приводит к смещению равновесия в обратную сторонуи делает реакцию неразрешенной термодинамически. В таких случаях применение катализатора не только оправдано, но и необходимо. Катализатор снижает энергию активации реакции и позволяет тем самым проводить ее при существенно более низких температурах.
 2015-08-12
2015-08-12 727
727








