[убрать]
· 1 История
· 2 Происхождение названия
· 3 Нахождение в природе
o 3.1 Месторождения
· 4 Геохимия и минералогия
· 5 Получение
· 6 Физические свойства
· 7 Химические свойства
o 7.1 Характерные степени окисления
o 7.2 Простое вещество
o 7.3 Соединения Cr(+2)
o 7.4 Соединения Cr(+3)
o 7.5 Соединения хрома (+4)
o 7.6 Соединения хрома (+6)
· 8 Применение
· 9 Биологическая роль и физиологическое действие
· 10 Интересные факты
· 11 См. также
· 12 Примечания
· 13 Ссылки
История[править | править вики-текст]
В 1766 году в окрестностяхЕкатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797французский химик Л. Н. Вокленвыделил из него новый тугоплавкийметалл (скорее всего Воклен получилкарбид хрома).
Происхождение названия[править | править вики-текст]
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Нахождение в природе[править | править вики-текст]
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения [править | править вики-текст]
Самые большие месторождения хрома находятся в ЮАР (1 место в мире), Казахстане, России,Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении[3],Бразилии, на Филиппинах[4].
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2 место в мире)[4].
Геохимия и минералогия[править | править вики-текст]
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы и их неточно называют «хромиты». Состав их изменчив:
· Cr2O3 18—62 %,
· FeO 1—18 %,
· MgO 5—16 %,
· Al2O3 0,2 — 0,4 (до 33 %),
· Fe2O3 2 — 30 %,
· примеси TiO2 до 2 %,
· V2O5 до 0,2 %,
· ZnO до 5 %,
· MnO до 1 %; присутствуют также Co, Ni и др.
Собственно хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение[править | править вики-текст]
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
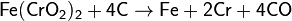
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
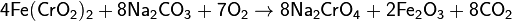
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
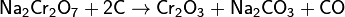
5) с помощью алюминотермии получают металлический хром:
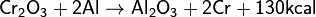
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
· восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
· разряд ионов водорода с выделением газообразного водорода;
· разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
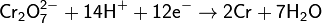
Физические свойства[править | править вики-текст]
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния вантиферромагнитное (точка Нееля).
Хром имеет твердость по шкале Мооса 5[5], один из самых твердых чистых металлов (уступает только бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Химические свойства[править | править вики-текст]
Характерные степени окисления [править | править вики-текст]
Для хрома характерны степени окисления +2, +3 и +6. (см. табл.) Практически все соединения хрома окрашены[6].
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
| +2 | CrO (чёрный) | Cr(OH)2(желтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3(зелёный) | Cr(OH)3(серо-зеленый) | Амфотерный | Cr3+ (зеленые или лиловые соли) [Cr(OH)4]-(зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | - | Встречается редко, малохарактерна |
| +6 | CrO3(красный) | H2CrO4 H2Cr2O7 | Кислотный | CrO42- (хроматы, желтые) Cr2O72-(дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
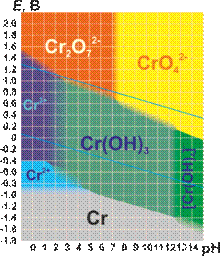
Диаграмма Пурбе для хрома
Простое вещество [править | править вики-текст]
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбидыCr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2) [править | править вики-текст]
Степени окисления +2 соответствует основный оксид CrO(чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
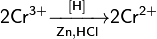
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды[7]. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3) [править | править вики-текст]
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6]3+) до зелёного (вкоординационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
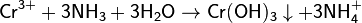
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
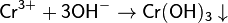
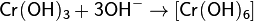
Сплавляя Cr2O3 со щелочами получают хромиты:
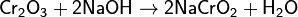
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
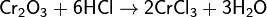
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
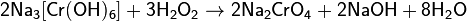
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
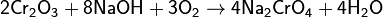
Соединения хрома (+4) [править | править вики-текст]
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6) [править | править вики-текст]
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
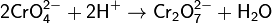
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат K2CrO4:
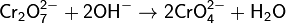
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
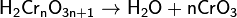
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтыйхромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
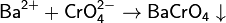
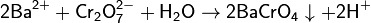
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
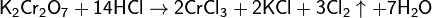
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение[править | править вики-текст]
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие[править | править вики-текст]
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина),углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Интересные факты[править | править вики-текст]
· Пиколинат хрома входит в состав средств для похудения.[8]
· Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содербергарассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.[9]
См. также[править | править вики-текст]
· Категория:Соединения хрома
· Хромтау
Примечания[править | править вики-текст]
1. ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Т. 85. — № 5. — С. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02
2. ↑ Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 308.
3. ↑ статья «Минеральные ресурсы». Энциклопедия «Кругосвет». Архивировано из первоисточника 21 августа 2011.
4. ↑ Перейти к: 12 ХРОМ | Онлайн Энциклопедия Кругосвет
5. ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
6. ↑ Реми Г. Курс неорганической химии. Т. 2. М., Мир, 1966. С. 142-180
7. ↑ Некрасов Б. В. Курс общей химии. М:, ГНХТИ, 1952, С. 334
8. ↑ Пиколинат хрома для похудения, отзывы диетологов и худеющих
9. ↑ Официальный сайт Эрин Брокович, страница, посвящённая фильму
Ссылки[править | править вики-текст]

| Хром на Викискладе? |
· Хром на Webelements
· Хром в Популярной библиотеке химических элементов
· Хром в месторождениях
· Хромовая зелень, применение в живописи
| [скрыть] Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
| H | He | |||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | |||||||||||||||||||||||||
|
 2015-08-21
2015-08-21 516
516






