Хаотичність теплового руху молекул газу, безперервні зіткнення між ними обумовлюють їх постійне переміщення і зміну швидкості та енергії. Якщо в газі існує просторова неоднорідність густини, температури або швидкості впорядкованого переміщення окремих його шарів, тепловий рух молекул вирівнює ці неоднорідності. Вирівнювання густини, кількості руху та енергії молекул газу мають багато спільного, тому й об’єднані спільною назвою – явища переносу. До них належать дифузія (перенос маси), теплопровідність (перенос енергії), внутрішнє тертя (перенос імпульсу).
|
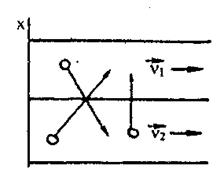 Явище внутрішнього тертя, або в’язкості, обумовлене появою сил тертя між шарами газу або рідини, що переміщуються паралельно один відносно одного з різними швидкостями (рис.11.1). Крім того, з боку шару, що рухається швидше, на повільний шар діє прискорювальна сила, і навпаки, повільний шар гальмує швидший. Сили тертя, які виникають унаслідок цього, направлені по дотичній до поверхні шарів. Із погляду молекулярно-кінетичної теорії газів причина внутрішнього тертя є накладання впорядкованого руху молекул у шарах газу, що переміщуються з різними швидкостями, на хаотичний тепловий рух молекул. Молекули, які переходять із більш швидкого шару в повільний, прискорюють останній, тому що мають більші швидкості й імпульси впорядкованого руху. Молекули менш швидкого шару, переходячи в більш швидкий, гальмують рух останнього.
Явище внутрішнього тертя, або в’язкості, обумовлене появою сил тертя між шарами газу або рідини, що переміщуються паралельно один відносно одного з різними швидкостями (рис.11.1). Крім того, з боку шару, що рухається швидше, на повільний шар діє прискорювальна сила, і навпаки, повільний шар гальмує швидший. Сили тертя, які виникають унаслідок цього, направлені по дотичній до поверхні шарів. Із погляду молекулярно-кінетичної теорії газів причина внутрішнього тертя є накладання впорядкованого руху молекул у шарах газу, що переміщуються з різними швидкостями, на хаотичний тепловий рух молекул. Молекули, які переходять із більш швидкого шару в повільний, прискорюють останній, тому що мають більші швидкості й імпульси впорядкованого руху. Молекули менш швидкого шару, переходячи в більш швидкий, гальмують рух останнього.|
|
|
Силу внутрішнього тертя між шарами можна знайти за законом Ньютона для внутрішнього тертя:
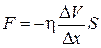 , (11.1)
, (11.1)
де 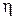 – коефіцієнт внутрішнього тертя (коефіцієнт в'язкості); S – площа між шарами;
– коефіцієнт внутрішнього тертя (коефіцієнт в'язкості); S – площа між шарами; 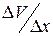 – градієнт швидкості, тобто величина, яка характеризує зміну швидкості в напрямку, перпендикулярному до шарів (напрям осі Х) (рис.11.1).
– градієнт швидкості, тобто величина, яка характеризує зміну швидкості в напрямку, перпендикулярному до шарів (напрям осі Х) (рис.11.1).
Коефіцієнт внутрішнього тертя для газів, як і для рідин, можна визначити експериментально на підставі закону Пуазейля. Метод Пуазейля заснований на вимірюванні об’єму V досліджуваного газу або рідини, що проходить за час τ через капілярну трубку.
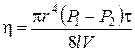 , (11.2)
, (11.2)
де r – радіус капіляра; l – довжина капіляра; P1 – P2 – різниця тиску на кінцях капіляра, під впливом якого відбувається витікання газу або рідини.
Молекулярний механізм сил внутрішнього тертя дозволяє пов’язати коефіцієнт внутрішнього тертя із середньою довжиною вільного пробігу молекул і їх середньою швидкістю, що видно з рівняння
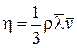 , (11.3)
, (11.3)
де 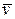 – середня швидкість молекул газу;
– середня швидкість молекул газу; 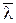 – середня довжина вільного пробігу молекул; ρ – густина газу.
– середня довжина вільного пробігу молекул; ρ – густина газу.
Середня довжина вільного пробігу, як відомо, обернено пропорційна густині газу 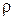 . Отже, згідно з формулою (11.3) коефіцієнт в'язкості газу (у певних межах) не залежить від його густини.
. Отже, згідно з формулою (11.3) коефіцієнт в'язкості газу (у певних межах) не залежить від його густини.
|
|
|
Оскільки середня швидкість молекул v прямо пропорційна кореню квадратному з абсолютної температури, коефіцієнт внутрішнього тертя, як випливає з формули (11.3), зі збільшенням температури зростає.
Середню швидкість молекул v і густину газу можна знайти за відомими формулами:
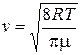 ,
, 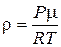 ,
,
де R – універсальна газова стала; T – абсолютна температура газу; 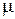 – молекулярна маса газу; Р – тиск газу, який можна приблизно вважати рівним атмосферному.
– молекулярна маса газу; Р – тиск газу, який можна приблизно вважати рівним атмосферному.
Отже, вимірявши коефіцієнт в'язкості η і обчисливши v i ρ, знайдемо середню довжину вільного пробігу молекул за формулою
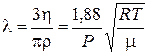 . (11.4)
. (11.4)
Середня довжина вільного пробігу молекул пов’язана з їх ефективним діаметром δ співвідношенням
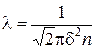 , (11.5)
, (11.5)
де n – концентрація молекул, яку можна знайти з рівняння
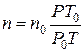 , (11.6)
, (11.6)
тут n0 – концентрація молекул (кількість молекул у 1 см3) за нормальних умов (число Лошмідта).
Отже,
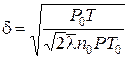 . (11.7)
. (11.7)
 2015-09-06
2015-09-06 188
188








