8. Вважатимемо, що потенціальна енергія відокремленої молекули, яка не взаємодіє з іншими молекулами, дорівнює нулю
9. Вивчення властивостей речовини показало, що та сама речовина може бути в твердому, рідкому, газоподібному станах, які часто називають агрегатними станами.
· Якщо молекули тільки коливаються навколо своїх середніх положень (положень рівноваги) то речовина залишається в твердому стані.
· Коли внаслідок нагрівання тіла енергія Епост збільшується то речовина переходить у рідкий стан: молекули продовжують коливатися, але багато молекул переходить у нове положення: речовина набуває текучості.
· При дальшому збільшенні температури тіла сили молекулярної взаємодії не можуть утримати молекули одну поблизу від одної, і вони розлітаються по всьому наданому їм простору, тобто речовина переходить у газоподібний стан.
Отже, якщо Епост <<Пмін, то речовина тверда; якщо Епост≈Пмін, то речовина рідка; якщо Епост >>Пмін, то речовина газоподібна.
10. Величину, яка характеризує ступінь нагрітості тіла, називають температурою цього тіла.
Для об'єктивного вимірювання температури було створено спеціальний прилад, який назвали т є р м о м є т р о м.
11. Сума кінетичної і потенціальної енергій всіх частинок тіла називається внутрішньою енергією цього тіла. Систему тіл, внутрішня енергія якої стала, називають замкненою або ізольованою системою.
12. Рух пилинок, зумовлений ударами молекул, які рухаються хаотично, називається броунівським рухом.
13. Молекули газу рухаються рівномірно і прямолінійно (за інерцією), поки не зіткнуться з іншими молекулами (або із стінками посудини). Під час зіткнення змінюються величина і напрям швидкості руху молекули, і молекула рухається з новою сталою швидкістю до наступного зіткнення.
Однак силами притягання не можна нехтувати, коли газ дуже стиснутий і середня відстань між його молекулами близька до радіуса молекулярної дії
14. Ідеальним газом називають газ молекули якого є матеріальними точками з деякими масами, що рухаються хаотично не взаємодіючи між собою.
15. Атомною одиницею маси називається 1/12 маси ізотопу вуглецю 12С, скорочене найменування — а. о. м.
16. Маса молекули (атома), виражена в атомних одиницях маси, називається відносною молекулярною (атомною) масою. Вона показує, у скільки разів маса молекули речовини більша за 1/12 маси ізотопу вуглецю 12С.
17.Молем називають кількість речовин, маса якої в грамах дорівнює її відносній молекулярній масі (mвід)- М= mвідн [г/моль] = mвідн [кг/моль].
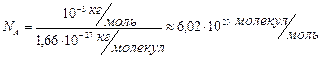 18. Kількість молекул у молі будь-якої речовини однакова. Кількість молекул в одному молі речовини називається сталою Авогадро. (позначається N А.
18. Kількість молекул у молі будь-якої речовини однакова. Кількість молекул в одному молі речовини називається сталою Авогадро. (позначається N А.
одиниця вимірювання - моль у мінус першому степені (моль-1))
В загальному випадку молем називається кількість речовини (у вигляді структурних елементів якогось певного роду), маса якої в грамах дорівнює відносній масі даного структурного елемента.. Часто користуються поняттям кіломоля (кмоль) речовини: 1 кмоль = = 1000 молів.
19. Один моль будь-якого газу за нормальних умов має об'єм 22,4 • 10-3 м3, або 22,4 л.
20. закон Авогадро: в рівних об'ємах різних газів при однаковому тиску і температурі міститься однакове число молекул,
21. Густиною тіла (речовини) називають фізичну величину яка показує масу тіла в одиниці його об’єму і визначається відношенням маси тіла до його об’єму. - 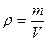
(позначається літерою – ρ, одиниця вимірювання – кілограм поділено на метр кубічний (кг/м3))
22. Концентрація – фізична величина яка показує кількість в одиниці об’єму і визначається відношенням кількості до одиниці об’єму. - 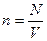
(позначається літерою – 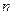 , одиниця вимірювання – метр у мінус третій степені (м-3))
, одиниця вимірювання – метр у мінус третій степені (м-3))
23.Фізичні властивості газу визначаються хаотичним рухом його молекул. Взаємодія молекул газу не має суттєвого впливу на його властивості, вона носить характер випадкових зіткнень, а отже притяганням та відштовхуванням молекул в більшості випадків можливо знехтувати. Такі припущення дозволяють ввести поняття ідеального газу.
24.Під ідеальним газом розумітимемо такий газ в якому взаємодією між молекулами можливо знехтувати, а самі молекули вважати матеріальними точками.
Всі реальні гази при невеликих тисках і низьких температурах описуються простим спільним законом, який є справедливим лише для ідеального газу.
25.Тиск в газах визначається ударами молекул об стінки посудини. Очевидно, що чим більше буде ударів за одиницю часу тим більшим буде тиск.
- Рівняння
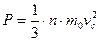 називають основним рівнянням МКТ. Із основного рівняння МКТ слідує: що величина тиску газу визначається його концентрацією та середньоквадратичною швидкістю руху молекул.
називають основним рівнянням МКТ. Із основного рівняння МКТ слідує: що величина тиску газу визначається його концентрацією та середньоквадратичною швидкістю руху молекул. - Отримаємо ще один вираз основного рівняння МКТ
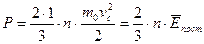
 2015-09-06
2015-09-06 1191
1191








