ЦЕЛЬ РАБОТЫ
Определение отношения теплоемкостей воздуха с по-мощью уравнений изопроцессов в идеальном газе.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Теплоемкостью тела называется величина, равная отно-шению бесконечно малого количества поглощенной теплоты 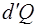 к бесконечно малому повышению температуры
к бесконечно малому повышению температуры 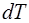 , вызванному поглощением этой теплоты:
, вызванному поглощением этой теплоты:
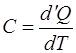 . (1.2.1)
. (1.2.1)
Если теплоемкость не зависит от температуры, то из оп-ределения следует, что она численно равна теплоте, погло-щаемой телом при нагревании на единицу температуры.
Теплоемкость единицы массы вещества называется удель-ной теплоемкостью, теплоемкость одного моля вещества – молярной теплоемкостью. Далее будем рассматривать мо-лярные теплоемкости.
Количество теплоты, поглощаемой телом, и, следова-тельно, теплоемкость тела зависят от способа нагревания. Различают теплоемкость при постоянном объеме 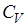 и теп-лоемкость при постоянном давлении
и теп-лоемкость при постоянном давлении 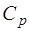 .
.
По Первому началу термодинамики количество теплоты 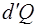 , сообщенное термодинамической системе, расходуется на увеличение внутренней энергии системы и совершение системой работы:
, сообщенное термодинамической системе, расходуется на увеличение внутренней энергии системы и совершение системой работы:
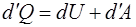 , (1.2.2)
, (1.2.2)
где 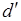 означает не приращение какой-либо функции а элементарное количество теплоты
означает не приращение какой-либо функции а элементарное количество теплоты 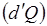 и работы
и работы 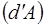 .
.
При изохорном нагревании газа (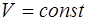 ) не происходит изменение объема (
) не происходит изменение объема (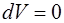 ), и поэтому работа газа
), и поэтому работа газа 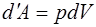 тоже равна нулю. Теплота, поглощенная телом, идет только на увеличение внутренней энергии тела (
тоже равна нулю. Теплота, поглощенная телом, идет только на увеличение внутренней энергии тела (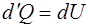 ). Исходя из этого теплоемкость
). Исходя из этого теплоемкость 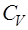 равна
равна
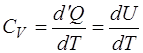 . (1.2.3)
. (1.2.3)
При изобарном нагревании (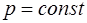 ) один моль расши-ряющегося газа совершает против внешних сил работу
) один моль расши-ряющегося газа совершает против внешних сил работу 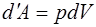 . Найдем зависимость работы, совершаемой газом, от изменения температуры. Для этого рассмотрим 1 моль га-за в двух состояниях – до поглощения теплоты (состояние 1) и после поглощения (состояние 2). В состоянии 1 газ имел следующие параметры:
. Найдем зависимость работы, совершаемой газом, от изменения температуры. Для этого рассмотрим 1 моль га-за в двух состояниях – до поглощения теплоты (состояние 1) и после поглощения (состояние 2). В состоянии 1 газ имел следующие параметры:
Давление: 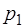 ,
,
Объем: 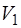 ,
,
Температура: 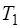 .
.
Запишем уравнение Менделеева–Клапейрона для состоя-ния 1:
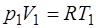 , (1.2.4)
, (1.2.4)
где 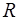 – универсальная газовая постоянная.
– универсальная газовая постоянная.
При переходе в состояние 2 газ при постоянном давле-нии увеличил свой объем на величину 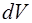 и температуру – на
и температуру – на 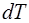 . Параметры газа в состоянии 2:
. Параметры газа в состоянии 2:
Давление: 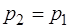 ,
,
Объем: 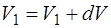 ,
,
Температура: 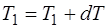 .
.
Уравнение Менделеева–Клапейрона для состояния 2:
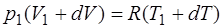 (1.2.5)
(1.2.5)
Вычтем из (1.2.4) выражение (1.2.5)
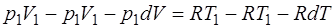
и получим выражение для работы, совершенной газом:
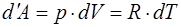 . (1.2.6)
. (1.2.6)
Из (1.2.6) виден физический смысл универсальной газо-вой постоянной 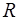 : она численно равна работе, совершае-мой 1 молем газа в процессе изобарного расширения при увеличении температуры на 1 кельвин. Разделив
: она численно равна работе, совершае-мой 1 молем газа в процессе изобарного расширения при увеличении температуры на 1 кельвин. Разделив 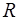 на коли-чество молекул в одном моле (число Авогадро
на коли-чество молекул в одном моле (число Авогадро 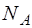 ), полу-чим работу, совершаемую одной молекулой против внеш-них сил при тех же условиях нагревания. Эта работа чис-ленно равна постоянной Больцмана
), полу-чим работу, совершаемую одной молекулой против внеш-них сил при тех же условиях нагревания. Эта работа чис-ленно равна постоянной Больцмана 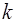 :
:
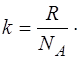 (1.2.7)
(1.2.7)
Подставим полученное выражение для работы (1.2.6) в уравнение Первого начала термодинамики (1.2.2):
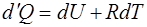 ,
,
и отсюда, с учетом (1.2.1), получаем выражение для тепло-емкости при постоянном давлении:
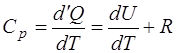 . (1.2.8)
. (1.2.8)
Подставляя в (1.2.8) выражение для 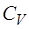 , получаем урав-нение
, получаем урав-нение
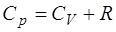 , (1.2.9)
, (1.2.9)
называемое уравнением Майера. Из уравнения Майера вид-но, что теплоемкости при постоянном давлении и объеме отличаются на константу. Из этого следует, что и отно-шение теплоемкостей – тоже величина постоянная. Вместе с тем неясно, от чего зависит теплоемкость 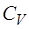 . Для того, чтобы вывести уравнение для
. Для того, чтобы вывести уравнение для 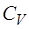 , проанализируем выраже-ние (1.2.3), описывающее зависимость
, проанализируем выраже-ние (1.2.3), описывающее зависимость 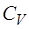 от внутренней энергии газа.
от внутренней энергии газа.
Внутренняя энергия газа зависит от числа степеней сво-боды молекул, составляющих газ. Числом степеней свобо-ды системы называется число независимых координат, оп-ределяющих положение системы в пространстве. Моле-кулы, состоящие из различного количества атомов, обла-дают и различным числом степеней свободы  . Для одно-атомного газа
. Для одно-атомного газа 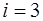 , для двухатомного
, для двухатомного 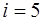 , для газа, моле-кулы которого состоят из трех и большего количества ато-мов,
, для газа, моле-кулы которого состоят из трех и большего количества ато-мов, 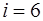 .
.
Из теоремы о равномерном распределении энергии по степеням свободы следует, что на каждую поступательную и вращательную степень свободы молекулы приходится одинаковая (в среднем) энергия, пропорциональная абсо-лютной температуре газа:
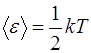 . (1.2.10)
. (1.2.10)
Соответственно, если молекула обладает 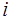 степенями сво-боды, то ее кинетическая энергия
степенями сво-боды, то ее кинетическая энергия
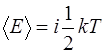 . (1.2.11)
. (1.2.11)
Тогда 1 моль идеального газа (газа, в котором можно пре-небречь взаимодействием молекул), состоящий из молекул с 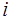 степенями свободы, согласно (1.2.7), обладает внутрен-ней энергией
степенями свободы, согласно (1.2.7), обладает внутрен-ней энергией
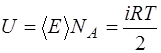 . (1.2.12)
. (1.2.12)
Таким образом, для молярной теплоемкости при посто-янном объеме 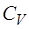 получаем выражение, зависящее только от числа степеней свободы молекул газа:
получаем выражение, зависящее только от числа степеней свободы молекул газа:
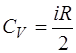 . (1.2.13)
. (1.2.13)
Из уравнения Майера получаем выражение для теплоем-кости при постоянном давлении:
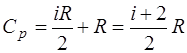 . (1.2.14)
. (1.2.14)
Тогда и отношение теплоемкостей есть величина посто-янная, зависящая от числа степеней свободы молекул газа:
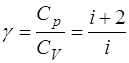 . (1.2.15)
. (1.2.15)
Если экспериментально определить величину 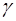 , то из (1.2.15) можно найти количество степеней свободы молекул данного газа:
, то из (1.2.15) можно найти количество степеней свободы молекул данного газа:
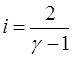 . (1.2.16)
. (1.2.16)
Величина 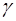 является одной из важнейших термодинами-ческих величин, она носит название показателя адиабаты. Адиабатический процесс – это процесс, проходящий без теплообмена со внешней средой (
является одной из важнейших термодинами-ческих величин, она носит название показателя адиабаты. Адиабатический процесс – это процесс, проходящий без теплообмена со внешней средой (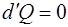 ). Состояние иде-ального газа при адиабатическом процессе описывается уравнением Пуассона:
). Состояние иде-ального газа при адиабатическом процессе описывается уравнением Пуассона:
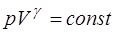 . (1.2.17)
. (1.2.17)
Адиабатический процесс тоже относится к изопроцессам, т.к. в отсутствие теплообмена энтропия 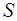 системы, опре-деляемая как
системы, опре-деляемая как
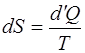 (1.2.18)
(1.2.18)
остается неизменной (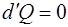 , следовательно,
, следовательно, 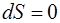 ).
).
Адиабатический процесс еще называется изоэнтропным, или 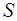 -процессом. Энтропия характеризует степень беспо-рядка в системе. Адиабатический процесс занимает особое место в термодинамике. Он характеризует связь между тер-модинамическими параметрами замкнутой макросистемы и поэтому является основой для установления взаимозави-симостей между параметрами. По Первому началу термоди-намики при адиабатическом процессе работа совершается системой за счет внутренней энергии
-процессом. Энтропия характеризует степень беспо-рядка в системе. Адиабатический процесс занимает особое место в термодинамике. Он характеризует связь между тер-модинамическими параметрами замкнутой макросистемы и поэтому является основой для установления взаимозави-симостей между параметрами. По Первому началу термоди-намики при адиабатическом процессе работа совершается системой за счет внутренней энергии 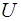 . Но если система находится в тепловом равновесии со средой, имеющей тем-пературу
. Но если система находится в тепловом равновесии со средой, имеющей тем-пературу 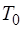 , то из энергии системы
, то из энергии системы 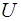 в виде работы отда-ется величина, не превышающая
в виде работы отда-ется величина, не превышающая 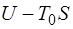 . Величина
. Величина 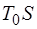 на-зывается связанной энергией. Она передается только через теплообмен. Поскольку связанная энергия пропорциональна энтропии, то энтропия характеризует обесцененность энер-гии системы: энтропия возрастает во всех процессах, уменьшающих способность системы производить работу.
на-зывается связанной энергией. Она передается только через теплообмен. Поскольку связанная энергия пропорциональна энтропии, то энтропия характеризует обесцененность энер-гии системы: энтропия возрастает во всех процессах, уменьшающих способность системы производить работу.
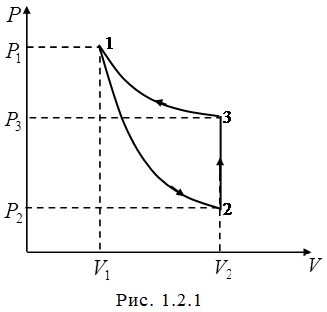
Исходя из физического смысла показателя адиабаты ло-гично сделать вывод, что эксперимент по определению ве-личины 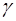 должен быть построен так, чтобы термодинами-ческая система хотя бы один раз переходила из состояния в состояние при помощи адиабатического процесса. Кроме того, желательно, чтобы система возвратилась в исходное состояние после прохождения нескольких процессов, т.е. совершила цикл, или круговой процесс. На рис.1.2.1 пред-ставлен такой цикл, состоящий из адиабаты 1-2, изохоры 2-3 и изотермы 3-1.
должен быть построен так, чтобы термодинами-ческая система хотя бы один раз переходила из состояния в состояние при помощи адиабатического процесса. Кроме того, желательно, чтобы система возвратилась в исходное состояние после прохождения нескольких процессов, т.е. совершила цикл, или круговой процесс. На рис.1.2.1 пред-ставлен такой цикл, состоящий из адиабаты 1-2, изохоры 2-3 и изотермы 3-1.
 |
Состояние идеального газа при изотермическом процессе (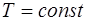 ) описывается уравнением Бойля-Мариотта
) описывается уравнением Бойля-Мариотта
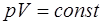 . (1.2.19)
. (1.2.19)
С учетом того, что 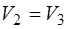 , уравнение (1.2.19) для изо-термы 3-1 имеет вид:
, уравнение (1.2.19) для изо-термы 3-1 имеет вид:
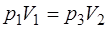 . (1.2.20)
. (1.2.20)
Уравнение (1.2.17) для адиабаты 1-2 записывается как:
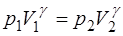 . (1.2.21)
. (1.2.21)
Уравнения (1.2.20) и (1.2.21) образуют систему уравне-ний, решая которую, мы найдем величину 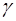 . Для этого воз-ведем уравнение (1.2.20) в степень
. Для этого воз-ведем уравнение (1.2.20) в степень 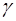 :
:
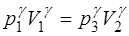 ,
,
и поделим его на уравнение (1.2.21). Получим:
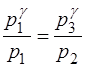 , или
, или 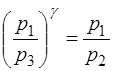 . (1.2.22)
. (1.2.22)
Логарифмируя уравнение (1.2.22), получим искомую величину:
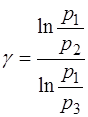 , (1.2.23)
, (1.2.23)
где 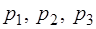 – давление газа, соответственно, в состоя-ниях 1,2,3 цикла, указанного на рис.1.2.1.
– давление газа, соответственно, в состоя-ниях 1,2,3 цикла, указанного на рис.1.2.1.
Выражение (1.2.23) можно упростить, если во время про-ведения цикла давление 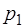 и
и 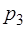 незначительно отличается от
незначительно отличается от 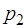 . Введем следующие обозначения для давления, пре-вышающего
. Введем следующие обозначения для давления, пре-вышающего 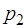 :
:
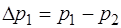 ; (1.2.24)
; (1.2.24)
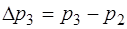 . (1.2.25)
. (1.2.25)
Тогда из рис. 1.2.1 следует, что
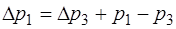 . (1.2.26)
. (1.2.26)
Соответственно выражение (1.2.22) для определения γ приобретает вид:
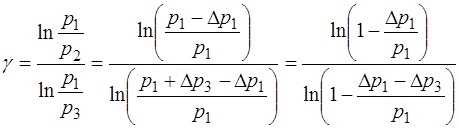 . (1.2.27)
. (1.2.27)
Используя разложение функции логарифма в ряд Маклорена и сохраняя только первый член разложения 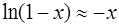 из (1.2.27), окончательно получаем
из (1.2.27), окончательно получаем
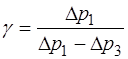 . (1.2.28)
. (1.2.28)
Для выяснения физического смысла полученного при-ближения (1.2.28) запишем уравнение изотермы (1.2.19) и адиабаты (1.2.17) в дифференциальном виде:
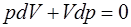 ; (1.2.29)
; (1.2.29)
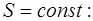
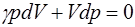 . (1.2.30)
. (1.2.30)
Из сравнения формул (1.2.29) и (1.2.30) очевидно, что отношение теплоемкостей 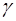 может быть найдено как отно-шение угловых коэффициентов адиабаты и изотермы, по-скольку
может быть найдено как отно-шение угловых коэффициентов адиабаты и изотермы, по-скольку
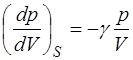 , (1.2.31)
, (1.2.31)
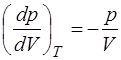 . (1.2.32)
. (1.2.32)
Объединяя соотношения (1.2.31) и (1.2.32), получаем ра-венство:
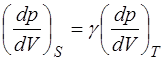 , (1.2.33)
, (1.2.33)
которое выполняется при любых заданных значениях 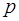 и
и 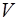 . Если по-прежнему считать, что в ходе цикла изменения
. Если по-прежнему считать, что в ходе цикла изменения 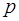 и
и 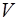 малы, то адиабату и изотерму можно с хорошей точ-ностью заменить отрезками прямых, угловые коэффици-енты которых на интервале
малы, то адиабату и изотерму можно с хорошей точ-ностью заменить отрезками прямых, угловые коэффици-енты которых на интервале 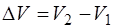 соответственно рав-ны:
соответственно рав-ны:
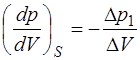 , (1.2.34)
, (1.2.34)
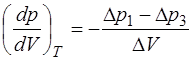 (1.2.35)
(1.2.35)
Таким образом, для отношения теплоемкостей вновь по-лучаем выражение (1.2.28):
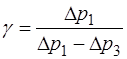 , (1.2.36)
, (1.2.36)
которое в работе используется в качестве расчетного.
Преимущество данного подхода и полученного прибли-женного соотношения (1.2.36) заключается в его простоте, высокой точности и возможности измерения давления в произвольных единицах (например в мм водяного столба). В настоящей работе 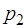 равно атмосферному давлению.
равно атмосферному давлению.
 2015-09-06
2015-09-06 195
195








