Величина электродного потенциала зависит от природы металла, концентрации ионов в растворе, температуры и определяется уравнением Нернста:
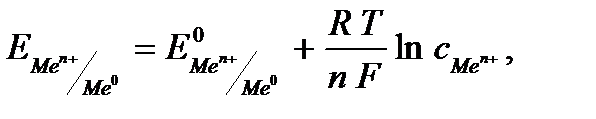
где 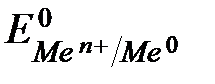 – стандартный электродный потенциал, возникающий на гра-
– стандартный электродный потенциал, возникающий на гра-
нице раздела металл – раствор при концентрации ионов металла 1 моль/л,
температуре 298 К и давлении 101 кПа;
R ─ универсальная газовая постоянная;
Т ─ температура, К;
n ─ число электронов, принимающих участие в процессе на электроде;
F ─ число Фарадея;
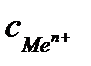 – концентрация ионов металла в растворе.
– концентрация ионов металла в растворе.
С учётом постоянных величин и для температуры 298 К уравнение Нернста имеет вид:
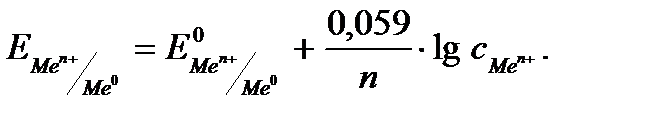
Значения стандартных электродных потенциалов содержатся в справочной литературе, некоторые из них представлены в табл. 5.1.
 2015-09-06
2015-09-06 1517
1517








