Среди химических веществ, загрязняющих окружающую среду (воздух, воду, почву) тяжелые металлы и их соединения образуют значительную группу веществ, оказывающих существенное неблагоприятное воздействие на человека. Высокая токсичность и опасность тяжелых металлов для здоровья человека, возможность их рассеяния в окружающей среде диктует необходимость контроля и разработки мер защиты от них.
Источники загрязнения биосферы тяжелыми металлами:
-предприятия черной и цветной металлургии (аэрозольные выбросы, загрязняющие атмосферу, промышленные стоки, загрязняющие поверхностные воды);
- машиностроения (гальванические ванны меднения, никелирования, хромирования, кадмирования);
-заводы по переработке аккумуляторных батарей, -автомобильный транспорт.
Опасность тяжелых металлов обусловлена их устойчивостью в окружающей среде, растворимостью в воде, сорбцией (поглощением) почвой, растениями, что в совокупности приводит к накоплению тяжелых металлов в среде обитания человека.
Согласно прогнозам, тяжелые металлы могут стать более опасными загрязнителями, чем отходы АЭС.
К тяжелым металлам относят более 40 химических элементов периодической системы Д.И. Менделеева с атомными массами более 50 а.е.м. Число наиболее опасных тяжелых металлов, если учитывать их токсичность, стойкость, способность накапливаться в окружающей среде, а так же масштабы распространения значительно меньше указанного
(Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg.)
В организм человека они попадают с продуктами питания и водой, а также через органы дыхания. В организме человека тяжелые металлы образуют сложные соединения, которые вызывают поражение живой ткани, что приводит к нарушениям работы отдельных систем или организма в целом.
О вредности тяжелых металлов можно судить по ПДК, значения которых для наиболее опасных элементов приведено в таблице
| Наименование | Условное обозначение | Среднесуточная ПДК, мг/м3 | № группы опасности |
| Свинец | Pb | 0,0003 | |
| Ртуть | Hg | 0,0003 | |
| Никель | Ni | 0,0002 | |
| Селен | Se | 0,00005 | |
| Мышьяк | As | 0,0003 | |
| Кадмий | Cd | 0,001 | |
| Медь | Cu | 0,002 | |
| Марганец | Mn | 0,001 | |
| Цинк | Zn | 0,05 | |
| Олово | Sn | 0,05 |
В то же время некоторые тяжелые металлы крайне необходимы организму.
Железо входит в состав гемоглобина крови и многих окислительных ферментов. Его недостаток в организме может вызвать такое заболевание, как анемия (малокровие). Суточная норма поступления железа в организм – 15 мг. Из продуктов много железа содержится в печени (особенно в свиной), зелени петрушки, яичном желтке, фруктах и овощах.
Медь входит в состав окислительных ферментов. Функции меди тесно связаны с функциями железа. Медь необходима, она влияет на процесс роста. Суточное поступление меди в организм – 2-5 мг. Наиболее богаты медью говяжья печень, печень палтуса и трески.
Кроме того, организм постоянно нуждается в ничтожно малых следовых количествах кобальта, стронция, марганца, цинка, цезия и других металлов. Но роль их в обмене веществ очень велика.
В качестве примера рассмотрим наиболее распространенные из тяжелых металлов, такие как свинец и ртуть.
Свинец Pb
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C
Температура кипения — 1740 °C
Значительное повышение содержания свинца в окружающей среде (в т.ч. и в поверхностных водах) связано со сжиганием углей, применением тетраэтилсвинца в качестве антидетонатора в моторном топливе, с выносом в водные объекты со сточными водами рудообогатительных фабрик, некоторых металлургических заводов, химических производств, шахт и т.д
В организм человека проникает главным образом через органы дыхания и пищеварения. Удаляется из организма очень медленно, вследствие чего накапливается в костях, печени и почках.
Отравление свинцом называется “ сатурнизм ”. Свинец и его соединения являются политропными ядами (т.е. действуют на разные органы и системы организма) и вызывают в основном изменения в нервной и сердечно-сосудистой системах, а также нарушения ферментативных реакций, витаминного обмена, снижают иммунобиологическую активность человека.
Высокая степень риска свинцового отравления отмечается у детей младшего возраста. Это объясняется тем, что детский организм сорбирует до 40 % поглощенного с пищей свинца, в то время как организм взрослого человека — всего от 5 до 10 %. Все соединения свинца очень ядовиты, особенно его органические производные. Соединения свинца откладываются в костях, а также в мышцах и печени. Действие свинца связано с глубоким нарушением обменных процессов, в первую очередь белкового обмена, минерального (кальция и фосфора) обмена и витаминного обмена. Наиболее частыми формами отравления свинцом являются малокровие, свинцовые колики, плеврит, гепатит. Уже при небольших дозах наступают нарушение кроветворных функций костного мозга и разрушение эритроцитов, что ведет к малокровию.
Ртуть – жидкий металл серебристо-белого цвета. Плотность – 13,52 г/см3, ТПЛ=-39°C, ТИСП=22-23°C, ТК=357°C. Он находит широкое применение при изготовлении термометров, светильников, ламп дневного света, измерительных приборов (манометров, барометров), в приготовлении препаратов для защиты дерева от гниения.
В организм человека ртуть попадает через органы дыхания, кожу, желудочно-кишечный тракт. Признаки отравления проявляются через 8-24 часа и выражаются в общей слабости, усилении головной боли, повышении температуры. Через некоторое время появляются боли в животе, наблюдается расстройство желудка, боли в деснах.
Пары ртути проникают в пористые материалы и там оседают, ртуть переходит в жидкое состояние. При повышении температуры ртуть вновь испаряется и этот процесс может повторяться многократно. При этом ПДК может превышаться в десятки тысяч раз.
Например, если в комнате площадью S=12 м2 (объем комнаты составит V = 30 м3) разбить градусник, в котором содержится 0,6 г ртути, и не удалить ртуть, то при температуры выше 23° С произойдет ее испарение и концентрация ртути превысит ПДК в
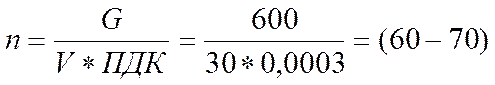 тыс. раз.
тыс. раз.
Средства защиты от ртути:
для органов дыхания:
- при незначительных концентрациях, необходимо пользоваться промышленным противогазом, оснащенным противогазовой коробкой черного цвета, имеющей маркировку буквы «Г» или респиратором РПГ-60Г;
- при повышенной концентрации, более 1мг/м3, необходимо пользоваться только изолирующим противогазом;
для кожи: специальная одежда.
Первая помощь при отравлении ртутью:
- при попадании ртути в желудочно-кишечный тракт необходимо промыть желудок водой с добавлением 20 – 30 г. активированного угля или водой с яичным белком, после чего дать молоко, а затем слабительное;
- при отравлении через органы дыхания больному необходим покой и немедленная медицинская помощь.
Основные методы удаления пролитой ртути (демеркуризация):
- механический: используя пластинку станиоля (бумагу) ртуть тщательно собрать и удалить в безопасное место;
- химический: приготовить раствор из 10 л воды, 20 мг марганцовокислого калия, 50 мг соляной кислоты и обильно смочить место разлива ртути; после высыхания это место промыть мыльной водой; вместо марганцовокислого калия для удаления ртути может быть использовано хлорное железо.
Тяжелые металлы в организм человека очень часто попадают с продуктами питания при использовании эмалированной посуды. Если эмаль имеет матовый цвет или сколы, то в пищу могут попадать кадмий, сурьма, цинк, кобальт, хром, свинец, медь, мышьяк и др. Такая посуда практическому использованию не подлежит.
 2015-10-16
2015-10-16 7123
7123
