Приложение
Дидактически блок
Способность к движению - одно из характерных свойств всех живых организмов, начиная от простейших и кончая самыми сложными. Сокращение разных мышц и движение листьев растений, биение ресничек и движение жгутиков, деление клеток и движение протоплазмы - все эти разнообразные формы проявления двигательной активности имеют общую черту -превращение химической энергии, освобождающейся при гидролизе АТФ, в механическую. То есть мышцы – это «машины», преобразующие химическую энергию непосредственно в механичесую энергию (работу) и теплоту. Регулятором двигательной активности в мышцах является кальций. Выяснение молекулярных механизмов генерации силы, трансформации химической энергии гидролиза АТФ в механическую работу, а также механизмов регуляции этих процессов является основной задачей биофизики биологической подвижности. Наибольшие успехи в этом направлении достигнуты при исследовании наиболее организованных поперечно-полосатых мышц позвоночных.
Прежде чем перейти к рассмотрению современных представлений о механизме сокращения мышцы, следует остановиться на структурной организации ее основных сократительных элементов -миофибрилл и саркомеров.
Строение мышечного волокна.
Миоцит
Скелетные мышцы состоят из многоядерных клеток, связанных возбудимой плазматической мембраной, по которой приходит нервный импульс, инициирующий сокращение мышцы. Диаметр миоцита значительно уступает его длине. Преобладание длины над толщиной в такой веретенообразной клетке позволяет называть ее волокном (рисунок 1). Вместе с тем следует отметить, что мышечное волокно образуется путем слияния множества отдельных клеток. Поэтому в миоците (весьма крупной клетке) содержится несколько ядер.
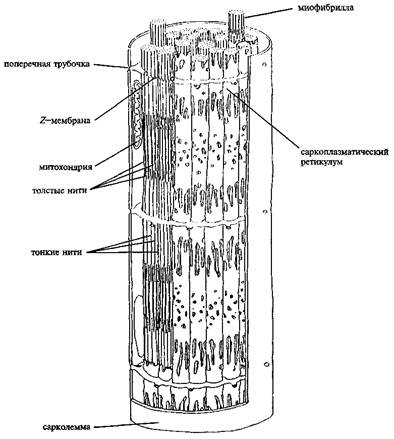
Рисунок 1. Схема структурной организации мышечной клетки (по Woledge R. et al., 1992). На одном из участков поперечная трубочка удалена для того, чтобы показать одну из Z-мембран, разделяющих миофибриллу на саркомеры
Мофибриллы
Внутри миоцита (в продольном его сечении) находится порядка 103 миофибрилл. Мышечные клетки состоят из множества сократительных волокон – миофибрилл, расположенных параллельно друг другу (рисунок 1). Мифибриллы – способные к сокращению, пучки нитей диаметром около 1 мкм. Перегородки, называемые Z-дисками, разделяют миофибриллы в поперечном направлении на отдельные компартменты длиной по 2,5 мкм, которые называются саркомерами
Структура саркомера
Саркомер является элементарной надмолекулярной сократительной единицей мышечного волокна. На электронно-микроскопических снимках продольного среза мышечной ткани видно, что саркомер состоит из параллельных рядов толстых и тонких нитей (рисунок 2, а). Вертикальные темные линии Z соответствуют специальным структурным белкам (десмину), разделяющим миофибриллы на саркомеры. Между ними видны горизонтальные нити сократительного аппарата. От Z-линий отходят тонкие нити, которым на электронно-микроскопических снимках соответствуют светлые полосы I. В центральной части саркомера расположены толстые нити, которым соответствуют темные полосы А. В середине каждой полосы А видна более светлая полоса Н. Наличие двух темных участков полосы А определяется тем, что в этих зонах толстые нити пересекаются тонкими нитями. Более светлая полоса (зона Н) соответствует участку саркомера, где толстые нити не пересекаются с тонкими нитями. Анизотропные диски (А) обладают двойным лучепреломлением (см. предыдущие темы): в обычном свете выглядят темными, а в поляризованном - прозрачными (светлыми) в продольном,и непрозрачными (темными) в поперечном направлениях. Изотропным дискам (I) не свойственно двойное лучепреломление.
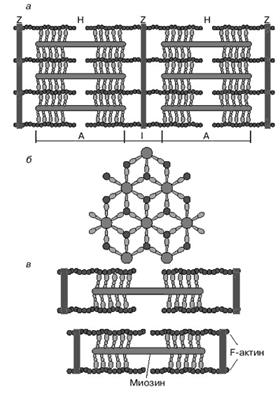
Рисунок 2. Схематическое изображение строения саркомеров мышечного волокна: а – продольный разрез, б – поперечный разрез в области пересечения толстых и тонких нитей, в – изменение длины саркомера в результате движения толстых и тонких нитей
Толстые нити состоят главным образом из молекул миозина. Тонкие нити содержат белки трех типов: актин, тропомиозин и тропонин. Если посмотреть на поперечный срез саркомера в области, где соседствуют толстые и тонкие нити (темный участок полосы А), то можно увидеть, что каждая тонкая нить окружена тремя толстыми нитями, а каждая толстая нить окружена шестью тонкими нитями (рис. 2 б). Взаимодействие между тонкими и толстыми филаментами осуществляется посредством так называемых поперечных мостиков, образованных головками миозиновых молекул (рисунки 2, 3а, 3в). Они расположены по отношению к продольной оси миозиновой нити под углом 120°. Поперечный мостик работает как химиомеханический преобразователь (т.е. преобразовывать энергию АТФ в механические гребковые движения). При сокращении мышцы (при движении ее актиновых и миозиновых нитей относительно друг друга) саркомер может уменьшить свою длину на одну треть (рисунок 2,в).
Тропонин,тропомиозин.
Для того чтобы толстые нити миозина начали гребковые движения (при сокращении) своими поперечными мостиками (рисунок 3, а), головка миозина должна вступить во взаимодействие с активным центром на актиновой нити. В расслабленной мышце он прикрыт («зачехлен») молекулой тропомиозина (рисунок 3, б). Молекула тропомиозина скручена вокруг двух нитей актина по спирали и перекрывает активные центры, с которыми должны вступить во взаимодействие миозиновые головки, чтобы произошло сокращение мышцы.
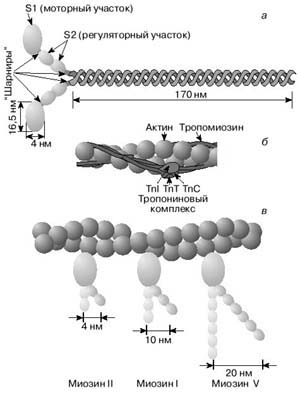
Рисунок 3. Строение молекулы миозина (а) и тонкой нити (б). В расслабленной мышце тропомиозин препятствует взаимодействию головки миозина с актином (б). Внизу (в) схематически показано различие геометрических характеристик моторных участков молекул миозина трех разных типов
Кроме актина, миозина и тропомиозина, миоциты поперечнополосатых мышц содержат важный регуляторный белок тропонин, который связан с актиновым филаментом и с тропомиозиновой нитью (рисунок 3, б). Одна из субъединиц, образующих тропониновый комплекс способна связываться с ионами Са2+. Когда такое взаимодействие происходит, тропонин воздействует на тропомиозин и тот освобождает на актиновом филаменте активный центр для миозина. Тем самым устраняется препятствие их взаимодействию (рисунок 3, в). Далее происходит непосредственно акт мышечного сокращения.
 2015-10-16
2015-10-16 11232
11232