| Кристаллические | Аморфные | |
| Атомы (молекулы) расположены в строго определенном порядке, не меняющемся во всем объеме кристалла (соль, лед, кварц, медь). | Отсутствует дальний порядок в расположении молекул (стекло, смолы). | |
| Проявляют упругость при механических воздействиях, как кратковременных, так и длительных. Тпл. = const | При кратковременных механических воздействиях проявляют упругие свойства, при длительных воздействиях текучи (проявляют свойства жидкостей). | |
| Обладают определенной температурой плавления Tпл. При T < Tпл тело останется твердым, при T > Tпл становится жидким. | Нет определенной температуры плавления. Переход из твердого состояния в жидкое происходит постепенно – вещество размягчается, растет текучесть. | |
| Монокристаллы | Поликристаллы | Изотропны. |
| Состоят из одиночных кристаллов (алмаз, турмалин). Анизотропны. | Состоят из множества одиночных кристаллов (металлы, сахар-рафинад) Изотропны. |
Анизотропия – зависимость физических свойств вещества (механических, тепловых, электрических, магнитных, оптических) от направления в кристалле.
Изотропия – независимость физических свойств вещества от направления в кристалле.
Экспериментальное определение скоростей молекул.
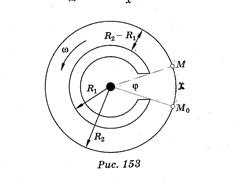 Опыт Штерна (1920г) – измерена скорость движения молекул серебра. В середине двух цилиндров находится платиновая проволока, покрытая серебром, по которой протекает электрический ток. Атомы серебра, испаряясь, оседают в виде полосок на
Опыт Штерна (1920г) – измерена скорость движения молекул серебра. В середине двух цилиндров находится платиновая проволока, покрытая серебром, по которой протекает электрический ток. Атомы серебра, испаряясь, оседают в виде полосок на
внутренней поверхности второго цилиндра:
- без вращения внешнего цилиндра в области точки М0;
- при вращении в области точки М, образуя более широкую
полоску.
Тогда 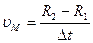 , но
, но 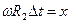 , поэтому
, поэтому 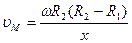
Выводы: наблюдаемое в опыте размытие полосок, говорит о различных скоростях атомов серебра при данной температуре. Атомы, движущиеся медленно, смещаются больше, чем атомы, движущиеся быстро. Толщина слоя серебра зависит от места конденсации атомов, а значит число атомов в этом месте зависит от их скорости. Результаты опыта подтвердили теоретические выкладки.
 Идеальный газ.
Идеальный газ.
Идеальный газ – молекулярно-кинетическая модель газа, в которой пренебрегают размерами молекул газа и потенциальной энергией их взаимодействия.
Давление газа в МКТ обусловлено ударами молекул о стенки сосуда. Это давление зависит от числа ударившихся молекул и температуры газа.
Термодинамическая система (ТДС) – любое макроскопическое тело или система тел. ТДС при неизменных условиях самопроизвольно переходит в состояние теплового равновесия.
Термодинамическое равновесие – это состояние, при котором все макроскопические параметры (параметры, описывающие поведение большого числа молекул) сколь угодно долго остаются неизменными.
Температура характеризует состояние теплового равновесия макроскопической системы: во всех частях системы, существующих в состоянии теплового равновесия, температура имеет одно и то же значение. При описании физических законов используют шкалу Кельвина.
Абсолютная температура измеряется в кельвинах (К). Она является мерой средней кинетической энергии движения молекул. 10С = 1 К Δt = ΔТ
Абсолютный нуль температуры (T = 0 К) – значение температуры, соответствующе 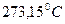 ниже нуля температуры по шкале Цельсия. Абсолютный ноль недостижим, так как в этом случае скорость теплового движения молекул равна нулю, чего не может быть.
ниже нуля температуры по шкале Цельсия. Абсолютный ноль недостижим, так как в этом случае скорость теплового движения молекул равна нулю, чего не может быть.
Нормальные условия: t = 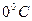 , Т=273 К, ратм = 105 Па = 1 атм.
, Т=273 К, ратм = 105 Па = 1 атм.
Параметры газа p,V,T.

p – давление
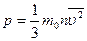
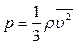
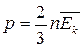
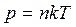
| V – объем
-прямоугольный сосуд:
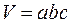 -цилиндрический сосуд:
-цилиндрический сосуд:
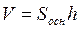
| Т – температура газа
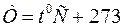
 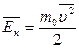 для 1-ой для 1-ой
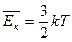 молекулы молекулы
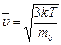 , , 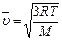
|

Уравнение состояния идеального газа.
| Уравнение Клапейрона (для данного газа при m = const) связывает несколько состояний газа. Уравнение Менделеева- Клапейрона | 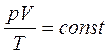
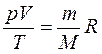
| Для смеси газов:
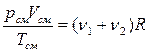 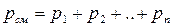 - закон Дальтона (давление смеси газов равно сумме парциальных давлений каждого газа в отдельности в объеме V). - закон Дальтона (давление смеси газов равно сумме парциальных давлений каждого газа в отдельности в объеме V).
|
описывает одно состояние
Газовые законы.

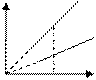
Изобарный процесс. Закон Гей- Люссака: для газа постоянной массы отношение объема к температуре постоянно, если давление газа не меняется.
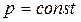 , , 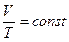
 V 1
Р2 > Р1
T V 1
Р2 > Р1
T
| Изохорный процесс.
Закон Шарля: для газа постоянной массы отношение давления к температуре постоянно, если объем не изменяется.
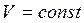 , , 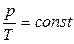
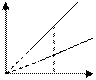 P 1
2 V2 > V1
0 T P 1
2 V2 > V1
0 T
| Изотермический процесс.
Закон Бойля-Мариотта: для газа постоянной массы произведение давления на объем остается постоянным, если температура газа не изменяется.
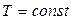 , , 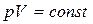
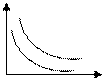 P P
 2 T2 > T1
V 2 T2 > T1
V
|

 Взаимные превращения жидкостей.
Взаимные превращения жидкостей.
Парообразование – процесс перехода вещества из жидкого или твердого состояния в газообразное.
Конденсация – процесс перехода вещества из газообразного состояния в жидкое.
 2015-10-13
2015-10-13 664
664








