Чаще всего задачами термодинамического анализа являются: 1) расчет теплового эффекта реакции; 2) выявление возможности самопроизвольного протекания реакции в данном направлении; 3) определение предела самопроизвольного протекания реакции, т.е. состояния химического равновесия. В результате определяют условия, при которых реакция будет протекать в нужном направлении, и равновесный состав, соответствующий заданным условиям.
Способы решения указанных задач термодинамического анализа изучаются в курсе физической химии. Ниже рассмотрен важнейший в технологическом отношении анализ влияния основных параметров проведения реакции на состояние химического равновесия.
Напомним, что с термодинамической точки зрения химическое равновесие определяется как наиболее устойчивое, вероятное состояние системы в данных условиях. Оно определяет тот предел, до которого при этих условиях химическая реакция может протекать самопроизвольно. В системах, находящихся в изобарно-изотермическом состоянии, равновесие устанавливается при достижении минимального для данных условии значения энергии Гиббса, т.е. при G = min или dG = 0.
С кинетической точки зрения условием химического равновесия в гомогенных системах является равенство скоростей прямой и обратной реакций. Основной характеристикой химического равновесия является константа равновесия. Для реакции типа
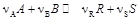 ,
,
протекающей в идеальной фазе, константу равновесия можно выразить следующими соотношениями:
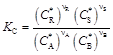 ; (5)
; (5)
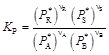 ; (6)
; (6)
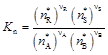 . (7)
. (7)
Формулы (5)–(7) получены на основе закона действующих масс и отличаются между собой принятыми единицами выражения содержания компонентов в равновесной системе (С * – концентрация; Р * – парциальное давление; n * – мольная доля). Подстановка известных равенств Р j = C j RT и Р j = n j P показывает, что между величинами К С, К Р и К n существует связь
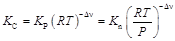 , (8)
, (8)
где Δν = (νR + νS) – (νA + νB) – изменение числа моль реагирующих веществ в результате реакции (при Δν = 0 К С = К Р = К n).
Константы равновесия К С и К Р численно изменяются только при изменении температуры, а К n – при изменении температуры и давления.
Константы равновесия чаще всего определяют термодинамическим расчетом. При этом для идеальной фазы обычно рассчитывают 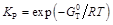 , зная которую, согласно (8), можно найти К С и К n.
, зная которую, согласно (8), можно найти К С и К n.
Экспериментально константу равновесия можно определить по известному составу равновесной реакционной смеси (см. формулы (5)–(7)). Однако этот метод связан с большими трудностями. Наиболее сложно достижение истинного равновесия и определение состава равновесной смеси.
Критерием достижения истинного равновесия служит одинаковость результатов, полученных при подходе к равновесию с двух противоположных сторон – по прямому и обратному пути. При определении состава равновесной смеси затруднения вызывает сохранение этого состава при анализе, что требует применения не химических, а физических аналитических методов.
При анализе состояния химического равновесия решают две задачи: 1) рассчитывают состав равновесной реакционной смеси; 2) определяют влияние на равновесный состав таких параметров проведения реакции, как температура, давление, содержание инертного компонента, начальное мольное соотношение реагентов, содержание продуктов реакции.
Состав равновесной реакционной смеси рассчитывают по величине константы равновесия. Вид расчетных уравнений определяется типом химической реакции. В качестве примера рассмотрим протекание в идеальной газовой фазе реакции 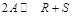 . Для нее
. Для нее
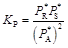 ;
; 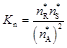 (
(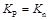 ).
).
Мольные доли
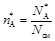 ;
; 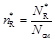 ;
; 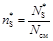 ,
,
где N см = N А + N R + N S в любой момент времени.
Тогда
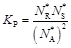 .
.
По стехиометрии реакции
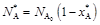 ;
;
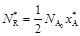 ; (9)
; (9)
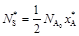 .
.
С учетом этого
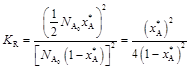 .
.
Отсюда равновесная степень превращения
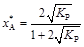 ,
,
и равновесный состав смеси можно рассчитать по соотношениям (9).
Влияние температуры на величину константы равновесия определяется по уравнению Вант-Гоффа
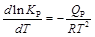 ,
,
где Q Р – тепловой эффект реакции.
Анализ этого уравнения показывает: 1) в случае эндотермических реакций (Q P < 0) производная всегда положительна (К Р и Т изменяются в одном направлении) и, следовательно, К Р возрастает при повышении температуры; 2) в случае экзотермических реакций (Q Р > 0) производная всегда отрицательна (К Р и Т изменяются в разных направлениях) и, следовательно, К Р возрастает при понижении температуры.
Влияние давления на величину константы равновесия определяется другим уравнением Вант-Гоффа
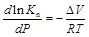 ,
,
где Δ V – изменение объема системы.
Аналогичный анализ позволяет сделать следующие выводы: 1) для реакций, протекающих с уменьшением объема (Δ V < 0), K n возрастает при повышении давления; 2) для реакций, протекающих с увеличением объема (Δ V > 0), К n возрастает при понижении давления; 3) для реакции, протекающих без изменения объема (Δ V = 0), давление на величину константы равновесия не влияет.
В свою очередь, при увеличении константы равновесии в равновесной смеси, как следует из уравнений (5)–(7), повышается содержание продуктов реакции и уменьшается содержание реагирующих веществ. Следовательно, возрастают равновесный выход продуктов и равновесная степень превращения реагентов.
Влияние содержания инертных компонентов на равновесный состав смеси можно показать на следующем примере. Пусть в идеальной фазе протекает реакция 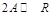 . Для нее
. Для нее
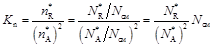 ;
;
где N см = N A + N R + N ин. комп..
Очевидно, что с повышением содержания инертных компонентов N ин. комп увеличится Nсм. Поскольку величина К n при этом остается постоянной (константа равновесия К n изменяется лишь при изменении Т и Р), то соотношение 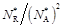 должно уменьшаться. Следовательно, снизится равновесный выход продукта R и равновесная степень превращения реагента А.
должно уменьшаться. Следовательно, снизится равновесный выход продукта R и равновесная степень превращения реагента А.
Аналогично можно показать, что для реакции 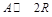 при повышении N ин. комп эти показатели будут возрастать. Таким образом, для реакций с Δ V < 0 благоприятное влияние оказывает понижение содержания инертных компонентов, а с ΔV > 0 – повышение его.
при повышении N ин. комп эти показатели будут возрастать. Таким образом, для реакций с Δ V < 0 благоприятное влияние оказывает понижение содержания инертных компонентов, а с ΔV > 0 – повышение его.
Влияние начального мольного соотношения реагентов на равновесный состав рассмотрим на следующем примере. Пусть в идеальной фазе протекает реакция 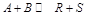 . Для нее
. Для нее
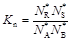 .
.
По стехиометрии
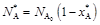 ;
; 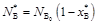 ;
;
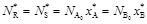 .
.
С учетом этого
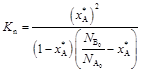 .
.
Отсюда
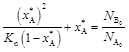 .
.
Анализ полученной зависимости показывает, что с увеличением 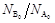 равновесная степень превращения
равновесная степень превращения 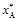 возрастает. Аналогично можно показать, что
возрастает. Аналогично можно показать, что 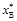 возрастает с увеличением соотношения
возрастает с увеличением соотношения 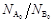 . Следовательно, для увеличения равновесной степени превращения одного из реагентов необходим избыток другого реагента.
. Следовательно, для увеличения равновесной степени превращения одного из реагентов необходим избыток другого реагента.
Влияние содержания продукта реакции. Из уравнения (7) следует, что уменьшение содержания продукта реакции в равновесной смеси при постоянной К n вызывает уменьшение равновесного содержания реагентов и, следовательно, увеличение равновесной степени превращения. Снижают содержание продуктов реакции частичным или полным выводом их из системы по мере накопления: 1) химическим связыванием с другими веществами; 2) переводом в другое фазовое состояние.
Все рассмотренные частные способы смещения равновесия следуют из общего принципа нарушения равновесия – принципа ле Шателье: если равновесная система выведена из состояния равновесия каким-либо воздействием, то в ней происходят изменения, направленные на уменьшение этого воздействия. Таким образом, на основании термодинамического анализа можно установить пути повышения выхода продукта, выбрать оптимальные условия проведения реакции – температуру, давление и состав исходной смеси. Однако следует иметь в виду, что этот выбор обычно не является окончательным. Во-первых, принцип ле Шателье относится к системам, близким к состоянию равновесия. Во-вторых, не исключено, что в условиях, оптимальных с термодинамической точки зрения, реакция будет протекать слишком медленно. Поэтому окончательный выбор оптимальных условий требует анализа протекания реакции во времени, т.е. кинетического анализа.
 2015-10-16
2015-10-16 5167
5167






