Избыток и недостаток реагентов. Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т. е. в соответствии с уравнениями реакции. Чаще один из реагентов берется в избытке, а следовательно, другой реагент оказывается в недостатке. Избыток реагента участвовать в реакции не будет.
Для реакции a A + b B = c C + d D определение реагентов, взятых в избыткеи в недостатке, проводят по неравенству (А – в недостатке, В – в избытке):
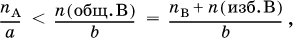
где n (общ. В) – общее (взятое с избытком) количество реагента В, п B – стехиометрическое (необходимое для реакции) количество В, n (изб. В) – избыточное количество В, причем
n (изб. B) = n (общ. B) – n B.
Внимание! Расчет получаемых количеств (масс, объемов) продуктов проводят по реагенту в недостатке.
Степень чистоты вещества. Химические вещества никогда не бывают идеально чистыми, они всегда содержат в себе примеси.
Массовая доля вещества В в смеси, например А + В + С, – это отношение массы вещества В к массе смеси:
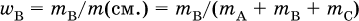
Сумма массовых долей всех веществ смеси равна 1 (100 %).
Если в смеси примесь присутствует в следовом (неопределяемом) количестве, то говорят о практически чистом веществе. Когда же в веществе имеется примесь в заметном (определяемом) количестве, то само вещество называют основным (его количество преобладает), а другое вещество – это и есть примесь.
Степень чистоты основного вещества В – это массовая доля этого вещества в навеске с определенной массой:
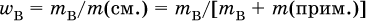
Природные вещества (минералы, руды) всегда содержат заметное количество примеси (примесей).
 2015-10-13
2015-10-13 584
584








