Вариант 1
С1. Используя метод электронного баланса, составьте уравнение реакции:
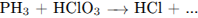
Определите окислитель и восстановитель.
Пояснение.
Элементы ответа:
1) Составлен электронный баланс:
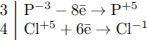
2) Расставлены коэффициенты в уравнении реакции
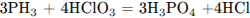
3) Указано, что фосфор в степени окисления -3 (или фосфин за счёт фосфора -3) является восстановителем, а хлор в степени окисления +5 (или хлорноватая кислота за счёт хлора +5) — окислителем.
С2 Даны водные растворы: сульфида натрия, сероводорода, хлорида алюминия и хлора.Напишите уравнения четырёх возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
Пояснение.
Элементы ответа:
Написаны четыре уравнения возможных реакций между указанными веществами:
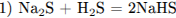
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
|
|
|
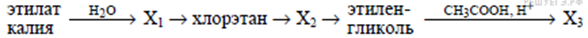
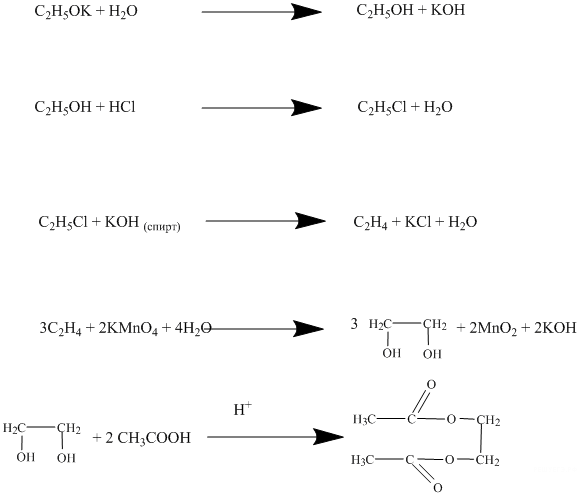
При написании уравнений реакций используйте структурные формулы органических веществ.
Пояснение.
С4. Оксид фосфора(V) массой 14,2 г растворили в 100 г воды. Полученный раствор полностью нейтрализовали 20%-м раствором гидроксида натрия. Рассчитайте массовую долю соли в образовавшемся растворе.
Пояснение.
Запишем уравнение реакции и рассчитаем количество вещества образовавшейся фосфорной кислоты:
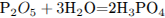
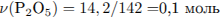
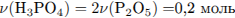
Запишем уравнение полной нейтрализации и определим количество вещества гидроксида натрия:
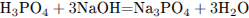
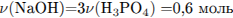
Определим массу раствора NaOH, и найдем массу конечного раствора:
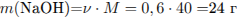
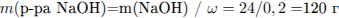
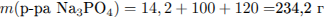
Найдем массу соли и её массовую долю в полученном растворе:
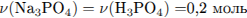
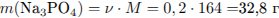
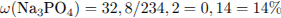
С5. При сгорании бескислородного органического вещества образовалось 4,48 л (н.у.) углекислого газа, 3,6 г воды и 3,65 г хлороводорода. Определите молекулярную формулу сгоревшего соединения.
Пояснение.
Составим схему реакции:
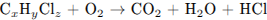
Найдем количество веществ углекислого газа, воды, хлороводорода:
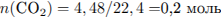
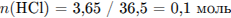
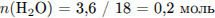
Найдем соотношение атомов углерода, водорода и хлора, и определим молекулярную формулу
соединения:

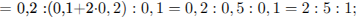
молекулярная формула  .
.
Вариант 2
С1. Используя метод электронного баланса, составьте уравнение реакции:
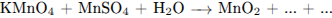
Определите окислитель и восстановитель.
Пояснение.
Элементы ответа:
1) Составлен электронный баланс:
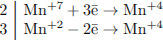
2) Расставлены коэффициенты в уравнении реакции
|
|
|
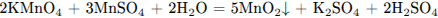
3) Указано, что MnSO4 является восстановителем (за счёт марганца со степенью окисления +2), а KMnO4 — окислителем (за счёт марганца со степенью окисления +7).
С2. Даны: хлорид меди (II), кислород, серная кислота (конц.) и йодоводородная кислота.
Напишите уравнения четырёх возможных реакций между всеми предложенными ве-ществами, не повторяя пары реагентов.
Пояснение.
Элементы ответа:
Записаны уравнения четырёх реакций между указанными веществами:
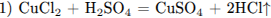
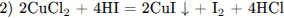
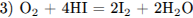
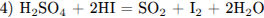
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
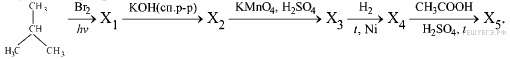
Пояснение.
Написаны пять уравнений реакций, соответствующих схеме превращений:
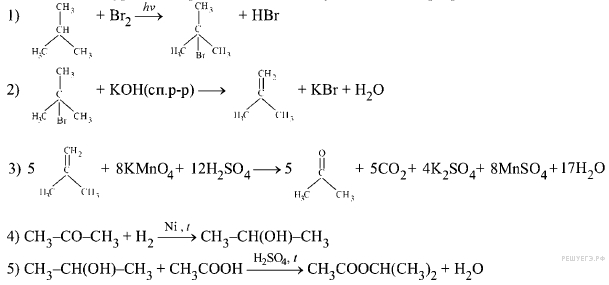
С4. Рассчитайте массовую долю азотной кислоты в растворе, полученном смешением 200 мл 15%-ного раствора серной кислоты плотностью 1,2 г/мл и 150 мл 10%-ного раствора нитрата бария плотностью 1,04 г/мл.
Пояснение.
Составим уравнения реакций:
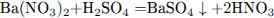
Рассчитаем количество моль серной кислоты:
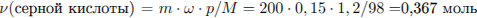
Рассчитаем количество моль нитрата бария:
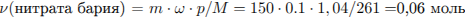
Таким образом, выпадет осадок 0,060 моль сульфата бария, который не будет учитываться при расчете массовой доли азотной кислоты.
Рассчитаем массовую долю азотной кислоты:
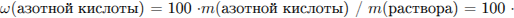
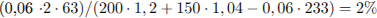
С5. Неизвестный алкен массой 1,96 г способен вступить в химическую реакцию с 2,56 г хлороводорода. Определите молекулярную формулу неизвестного алкена.
Пояснение.
Составим схему реакции и определим количество вещества алкена:
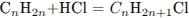
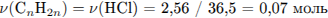
Найдем молярную массу алкена:
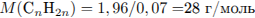
Определим число атомов углерода и составим молекулярную формулу:
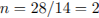
Формула вещества — 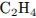 .
.
Вариант 3
Задание С1.
Используя метод электронного баланса, составьте уравнение реакции
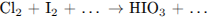
Определите окислитель и восстановитель.
Пояснение.
1) Составлен электронный баланс:
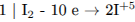
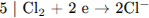
2) Указано, что иод в степени окисления 0 является восстановителем, а хлор в степени окисления 0 – окислителем.
3) Определены недостающие вещества, и расставлены коэффициенты в уравнении реакции:
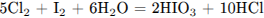
С2. Вещество, выделяющееся на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт поместили в газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
Пояснение.
При электролизе расплава соли на катоде выделяется металл (уравнение 1). При горении натрия преимущественно образуется пероксид натрия (уравнение 2), который реагируете углекислым газом с выделением кислорода (уравнение 3). При нагревании раствора, содержащего NH4Cl (соль, образованная слабым основанием и сильной кислотой) и Na2C03 (соль, образованная сильным основанием и слабой кислотой), будет происходить гидролиз (уравнение 4).

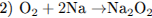
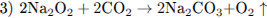
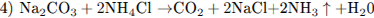
С3. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
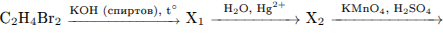
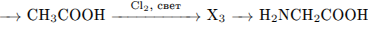
Пояснение.
Элементы ответа:
Написаны уравнения реакций, соответствующие схеме превращений, и одновременно указаны условия их протекания:
1) 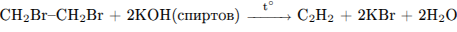
2) 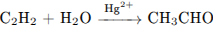
3) 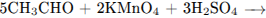
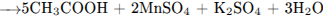
4) 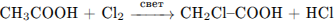
5) 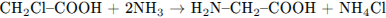
С4. Смесь аммиака и водорода разделили на две равные части. При пропускании первой части через трубку с раскалённым оксидом меди (II) масса трубки уменьшается на 8,0 г, а вторая часть может нейтрализовать 120 г 12,6%-ной азотной кислоты. Рассчитайте объёмные доли газов в исходной смеси.
|
|
|
Пояснение.
1) Составлены уравнения реакций:
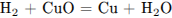
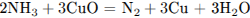
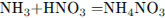
2) Рассчитано количество вещества аммиака:
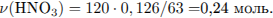
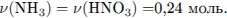
3) Рассчитано количество вещества водорода:

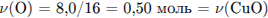
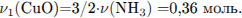
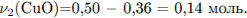

4) Рассчитаны объёмные доли газов в смеси:
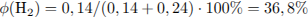

С5. В результате реакции предельного одноатомного спирта с 18,25 г хлороводорода получили 46,25 г продукта реакции и воду. Определите молекулярную формулу спирта.
Пояснение.
Напишем уравнение реакции спирта с хлороводородом в общем виде:

Определим количество вещества хлороводорода, и сделаем вывод о количестве вещества спирта:
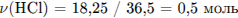
Так как спирт и хлороводород реагируют в молярном соотношении 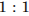 , то
, то 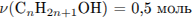 .
.
Определим молекулярную массу спирта и его молекулярную формулу:
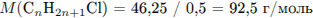
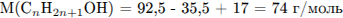
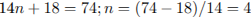
Молекулярная формула спирта — 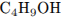
Вариант 4
С1. Используя метод электронного баланса, составьте уравнение реакции.
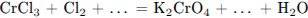
Определите окислитель и восстановитель.
Пояснение.
1) Составлен электронный баланс.
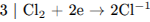
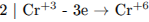
2) Указаны окислитель и восстановитель:
окислитель — 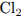
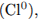 восстановитель —
восстановитель — 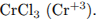
3) Определены недостающие вещества, и составлено уравнение реакции.
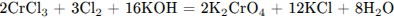
С2. Кальций нагрели в атмосфере водорода. Продукт реакции обработали водой, выделяющийся газ пропустили над нагретым оксидом цинка, а в раствор добавили кальцинированную соду. Напишите уравнения описанных реакций.
Пояснение.
При взаимодействии очень активного металла кальция с водородом образуется гидрид кальция (уравнение 1). Гидрид кальция взаимодействует с водой с образованием гидроксида кальция и выделением водорода (уравнение 2). Водород способен восстанавливать некоторые металлы из их оксидов (уравнение 3). При добавлении в раствор Са(ОН)2 кальцинированной соды образуется нерастворимый карбонат кальция и в растворе остаётся щёлочь (уравнение 4); эта реакция раньше использовалась для получения едкого натра.
|
|
|
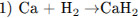
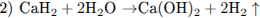

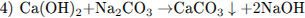
С3. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
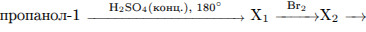
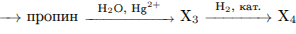
Пояснение.
Элементы ответа:
Написаны уравнения реакций, соответствующие схеме превращений:
1) 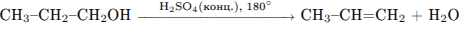
2) 
3) 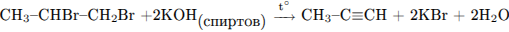
4) 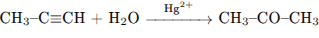
5) 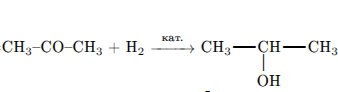
С4. К раствору, полученному при добавлении 4 г гидрида калия к 100 мл воды, прилили 100 мл 39%-ного раствора азотной кислоты (р = 1,24 г/мл). Определите массовые доли всех веществ (включая и воду) в конечном растворе.
Пояснение.
Составим уравнения реакций:
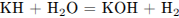
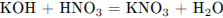
Вычислим количество веществ гидроксида калия и азотной кислоты, сделаем
вывод о том, какое из веществ находится в избытке:
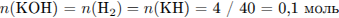
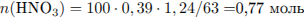 — в избытке
— в избытке
Вычислим массу раствора и массы составляющих его веществ:
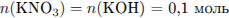
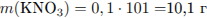
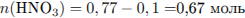
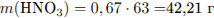
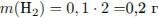
Определим массовые доли веществ в растворе:
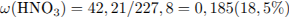
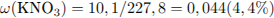
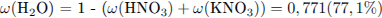
С5. Для полного гидрирования гомолога бензола потребовалось 1,68 л (н.у.) водорода, при этом образовался циклоалкан массой 3,15 г. Запишите уравнение реакции в общем виде. Определите молекулярную формулу гомолога бензола. Считать выход продукта реакции равным 100%.
Пояснение.
Напишем уравнение реакции в общем виде:
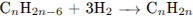
Рассчитаем молярную массу:
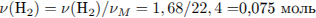
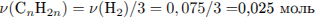
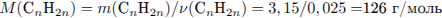
Установим молекулярную формулу:
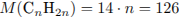
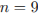
Молекулярная формула — 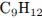
Вариант 5
С1. Составьте уравнение окислительно-восстановительной реакции, используя метод электронного баланса:
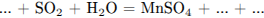
Укажите окислитель и восстановитель.
Пояснение.
Элементы ответа.
1) Составлен электронный баланс:
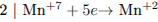
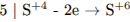
2) Указаны окислитель и восстановитель:
окислитель — 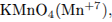 восстановитель —
восстановитель — 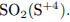
3) Расставлены коэффициенты в уравнении реакции:
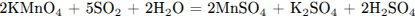
С2. При сжигании на воздухе простого вещества жёлтого цвета образуется газ с резким запахом. Этот газ выделяется также при обжиге некоторого минерала, содержащего железо, на воздухе. При действии разбавленной серной кислоты на вещество, состоящее из тех же элементов, что и минерал, но в другом соотношении, выделяется газ с характерным запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуется исходное простое вещество. Напишите уравнения описанных реакций.
Пояснение.
Простое вещество жёлтого цвета, горящее на воздухе с выделением газа с резким запахом, — сера (уравнение 1). Вещества, содержащие железо и серу: минерал пирит FeS2 и сульфид железа (II) (уравнения 2 и 3). При взаимодействии оксида серы (IV) и сероводорода первый проявляет свойства окислителя, второй — восстановителя и образуется простое вещество — сера (уравнение 4).
Простое вещество — сера, минерал — FeS2; FeS.
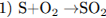
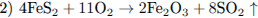
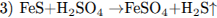
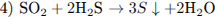
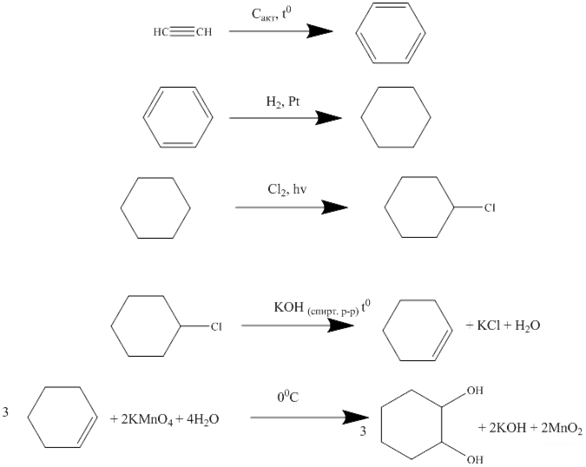
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
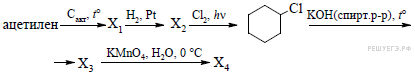
При написании уравнений реакций используйте структурные формулы органических веществ.
Пояснение.
С4. Сероводород, выделившийся при взаимодействии избытка концентрированной серной кислоты с 1,44 г магния, пропустили через 160 г 1,5%-ного раствора брома. Определите массу выпавшего при этом осадка и массовую долю кислоты в образовавшемся растворе.
Пояснение.
Составим уравнение реакции магния с серной кислотой:
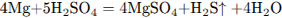
Определим количество вещества 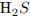 :
:
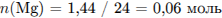
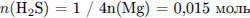
Составим уравнение реакции сероводорода с бромом:
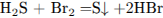
и рассчитаем массу 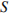 :
:
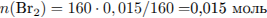
Так как, согласно уравнению, вещества взяты в эквивалентном соотношении, то
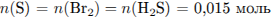
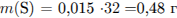
Определим массовую долю 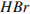 в растворе:
в растворе:
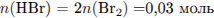
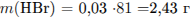
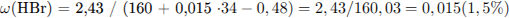
С5. В результате сжигания 1,74 г органического соединения получено 5,58 г смеси 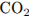 и
и 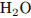 . Количества веществ
. Количества веществ 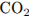 и
и 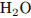 в этой смеси оказались равными. Определите молекулярную формулу органического соединения, если относительная плотность его по кислороду равна 1,8125.
в этой смеси оказались равными. Определите молекулярную формулу органического соединения, если относительная плотность его по кислороду равна 1,8125.
Пояснение.
Рассчитаем молярную массу и количество вещества органического соединения:
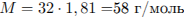
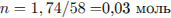
Определим количество вещества углекислого газа и воды, полученных при сгорании органического
соединения, и рассчитаем число атомов углерода и водорода в нём:
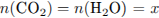
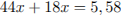
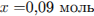
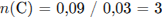
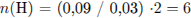
Определим число атомов кислорода и молекулярную формулу органического соединения:
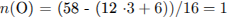
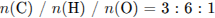
Молекулярная формула 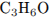
Вариант 6
С1. Используя метод электронного баланса, составьте уравнение реакции:
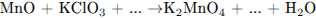
Определите окислитель и восстановитель.
Пояснение.
Элементы ответа.
1) Составлен электронный баланс:
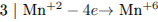
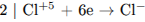
2) Указаны окислитель и восстановитель:
окислитель — 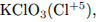 восстановитель —
восстановитель — 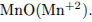
3) Расставлены коэффициенты в уравнении реакции:

С2. Сульфит натрия растворили в разбавленной серной кислоте. Выделившийся бесцветный газ растворили в воде и через полученный раствор пропустили газ, образовавшийся при растворении сульфида цинка в соляной кислоте. Осадок отфильтровали и растворили в концентрированной азотной кислоте. Напишите уравнения четырёх описанных реакций.
Пояснение.
Написаны 4 уравнения реакций:
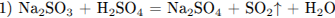
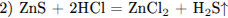
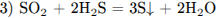
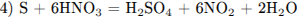
(допускается уравнение реакции с образованием 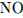 :
:
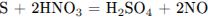 )
)
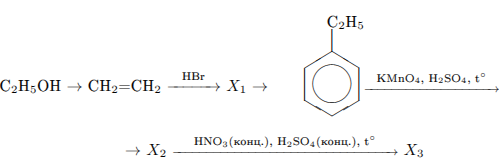
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Пояснение.
Элементы ответа:
Составлены уравнения реакций, соответствующих схеме превращений:
1) 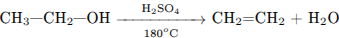
2) 
3) 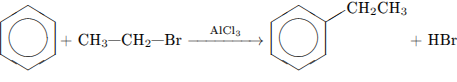
4) 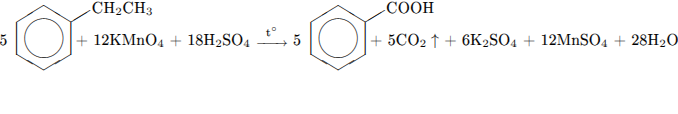
5) 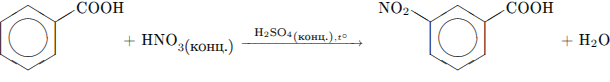
С4. Магний массой 4,8 г растворили в 200 мл 12%-ного раствора серной кислоты (р = 1,05 г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
Пояснение.
Составим уравнение химической реакции:
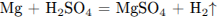
Рассчитаем массу веществ, полученных в ходе реакции:
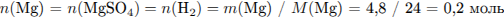
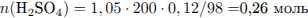 — в избытке
— в избытке
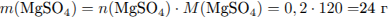
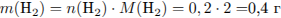
Рассчитаем массу раствора:
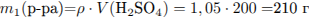
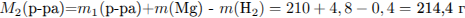
Найдем массовую долю 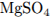 :
:
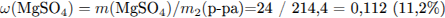
С5. Установите молекулярную формулу алкена, если известно, что 0,5 г его способны присоединить 200 мл (н.у.) водорода.
Пояснение.
Запишем уравнение реакции гидрирования алкена и определим количество вещества водорода:
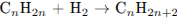
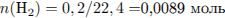
Рассчитаем молекулярную массу алкена:
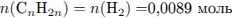
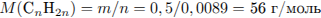
Установим молекулярную формулу алкена:
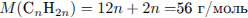
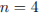
Молекулярная формула 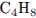
Вариант 7
С1. Используя метод электронного баланса, составьте уравнение реакции:
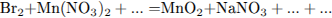
Определите окислитель и восстановитель.
Пояснение.
1) Составим электронный баланс:
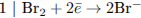
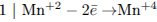
2) Укажем окислитель и восстановитель:
окислитель — 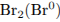 ,
,
восстановитель — 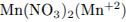 .
.
3) Определим недостающие вещества, и составим уравнение реакции с коэффициентами:
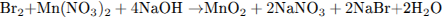
С2. Кристалличесюе вещество оранжевого цвета при нагревании значительно увеличивается в объёме за счёт выделения бесцветного газа и образует твёрдое вещество тёмно-зелёного цвета. Выделившийся газ взаимодействует с литием даже при комнатной температуре. Продукт этой реакции гидролизуется водой с образованием газа с резким запахом, способного восстановить медь из её оксида. Напишите уравнения описанных реакций.
Пояснение.
Элементы ответа.
Написаны 4 уравнения реакций:
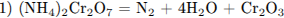
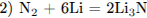
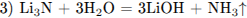
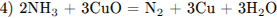
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
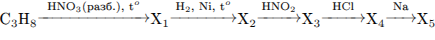
В уравнениях укажите структурные формулы органических веществ.
Пояснение.
Написаны пять уравнений реакций, соответствующих схеме превращений:
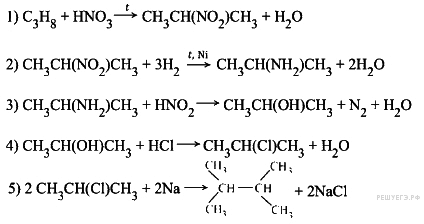
С4. Смесь карбонатов магния и бария растворили в избытке азотной кислоты. Выделился газ объёмом 13,44 л (н.у.). При действии избытка серной кислоты на полученный раствор образовался осадок массой 46,6 г. Рассчитайте массовые доли (в %) веществ в исходной смеси.
Пояснение.
Составим уравнения реакций:
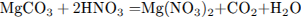
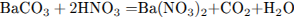
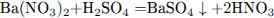
Рассчитаем количество вещества и массу карбоната бария:
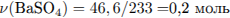
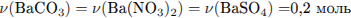
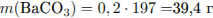
Рассчитаем количество вещества и массу карбоната магния:
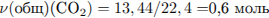
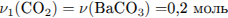

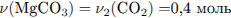
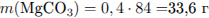
Рассчитаем массовые доли веществ в смеси:
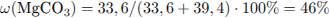
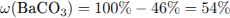
С5. Определите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, или 5,23 г хлорпроизводного, или 8,2 г бромпроизводного.
Пояснение.
Запишем уравнения реакций:
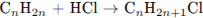
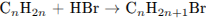
Укажем, что количества веществ галогеналканов равны друг другу:
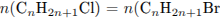
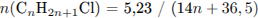
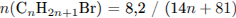
Решением алгебраического уравнения найдем молекулярную формулу алкена:
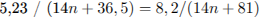

Молекулярная формула алкена 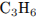
Вариант 8
С1. Используя метод электронного баланса, составьте уравнение реакции:
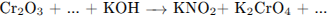
Определите окислитель и восстановитель.
Пояснение.
Элементы ответа:
1) Составлен электронный баланс:
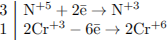
2) Расставлены коэффициенты в уравнении реакции
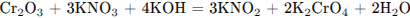
3) Указано, что хром в степени окисления +3 является восстановителем, а азот встепени окисления +5 (или нитрат калия за счёт азота в степени окисления +5) — окислителем.
С2. В двух сосудах находятся растворы неизвестных веществ. При добавлении к раствору первого вещества хлорида бария выпадает осадок белого цвета, нерастворимый в воде и кислотах. Осадок белого цвета выпадает также и при добавлении раствора нитрата серебра к пробе, отобранной из второго сосуда. При нагревании пробы первого раствора с гидроксидом натрия выделяется газ с резким запахом. При взаимодействии второго раствора с хроматом натрия выпадает осадок жёлтого цвета. Напишите уравнения описанных реакций.
Пояснение.
В первом сосуде находится раствор (NH4)2S04: образование осадка белого цвета при взаимодействии с ВаСl2 доказывает, что в веществе имеется сульфат-анион S02-4 (уравнение 1); выделение аммиака (газ с резким запахом) при нагревании с раствором щёлочи доказывает присутствие в веществе катиона аммония NH4 (уравнение 2).
Во втором сосуде находится раствор ВаСl2: осадок белого цвета, образовавшийся при добавлении AgN03, указывает на присутствие в веществе хлорид-иона Сl- (уравнение 3); осадок жёлтого цвета при добавлении раствора Na2CrO4 образуют соли Ва2+ (уравнение 4).
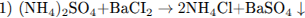
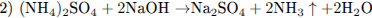
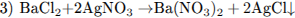
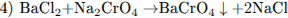
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
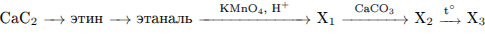
Пояснение.
Элементы ответа:
Написаны уравнения реакций, соответствующие схеме превращений:
1) 
2) 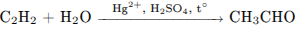
3) 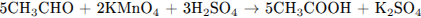
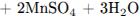
4) 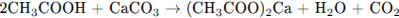
5) 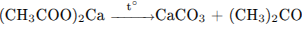
С4. Газ, выделившийся при взаимодействии 3,2 г меди с 100 мл 60%-ной азотной кислоты (плотностью 1,4 г/мл), растворили в 100 г 15%-ного раствора гидроксида натрия. Рассчитайте суммарную массовую долю солей в полученном растворе.
Пояснение.
Составим уравнение реакции меди с азотной кислотой:
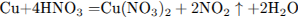
Определим количество вещества 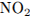 :
:
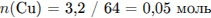
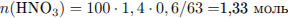 — в избытке
— в избытке
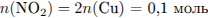
Составим уравнение реакции оксида азота(IV) с гидроксидом натрия:
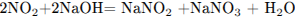
И рассчитаем массу солей:
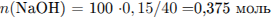 — в избытке
— в избытке
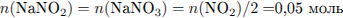
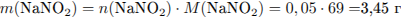
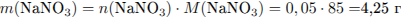
Определим суммарную массовую долю солей в растворе:
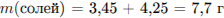
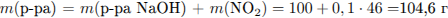
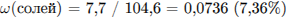
С5. Некоторый углеводород содержит 12,19% водорода по массе. Молекула этого углеводорода содержит один четвертичный атом углерода. Установлено, что этот углеводород может взаимодействовать с аммиачным раствором оксида серебра с образованием бурого осадка. На основании этих данных:
1) установите простейшую формулу углеводорода,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с аммиачным раствором оксида серебра.
Пояснение.
1) простейшая формула 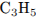 (не надо путать её с молекулярной формулой)
(не надо путать её с молекулярной формулой)
2) структурная формула
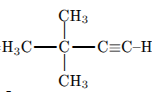
3) уравнение реакции 
Вариант 9
С1. Используя метод электронного баланса, составьте уравнение реакции:
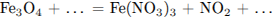
Определите окислитель и восстановитель.
Пояснение.
1) Составим электронный баланс:
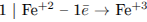
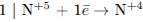
2) Укажем окислитель и восстановитель: окислитель — 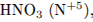 , восстановитель —
, восстановитель — 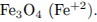
3) Определим недостающие вещества, и составим уравнение реакции:
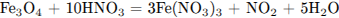
С2. Газ, полученный при растворении сульфида железа(II) в разбавленной серной кислоте, разделили на две части. Одну растворили в воде, а другую пропустили через раствор нитрата свинца. Выпавший осадок отфильтровали и сожгли в кислороде. Образовавшийся при этом газ пропустили через раствор, полученный из первой порции исходного газа, в результате раствор помутнел. Напишите уравнения четырёх описанных реакций.
Пояснение.
Написаны 4 уравнения реакций:
1) 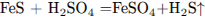
2) 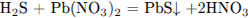
3) 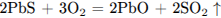 (вместо
(вместо 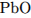 возможно образование
возможно образование 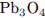 )
)
4) 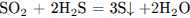
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
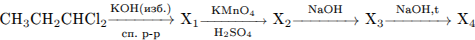
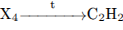
В уравнениях приведите структурные формулы органических веществ.
Пояснение.
Элементы ответа:
Написаны пять уравнений реакций, соответствующих схеме превращений:
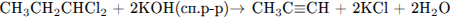
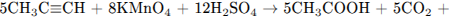
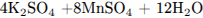

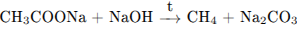
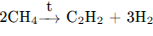
С4. Газ, полученный при взаимодействии 8,0 г меди с 60 г 80-процентного раствора азотной кислоты, пропустили на холоде через 25 мл 40-процентного раствора гидроксида калия (ρ = 1,4 г/мл). Рассчитайте массовые доли веществ в образовавшемся растворе.
Пояснение.
Составим уравнение реакции:
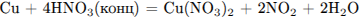
Рассчитаем количество вещества образовавшегося оксида азота (IV):
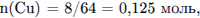
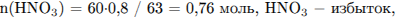
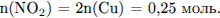
Составим уравнение реакции и определим количество вещества 
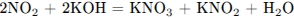
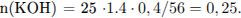
Количества веществ соответствуют уравнению реакции.
Определим массы 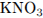 и
и 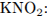
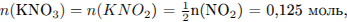
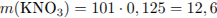
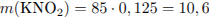
Определим массу раствора, и рассчитаем массовые доли солей в растворе:
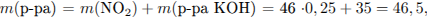
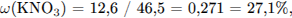
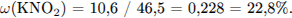
С5. При дегидрировании 52,8 г предельного спирта над медным катализатором образовалось 51,6 г кетона. Установите молекулярную формулу спирта, если известно, что реакция прошла количественно, то есть со 100-процентным выходом.
Пояснение.
Напишем уравнение реакции в общем виде:
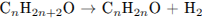
I способ.
Найдем массу водорода и рассчитаем количество вещества спирта:
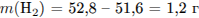
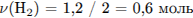
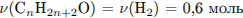
II способ.
Составим уравнение, связывающее количество вещества кетона и спирта
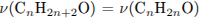
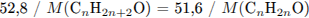
Установим молярную массу и определим молекулярную формулу спирта:
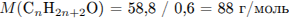
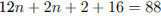
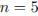
Формула спирта — 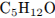 .
.
Вариант 13
С1. Используя метод электронного баланса, составьте уравнение реакции:
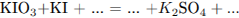
Определите окислитель и
1) Составим электронный баланс:
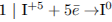
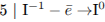
2) Укажем окислитель и восстановитель:
окислитель — 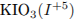
восстановитель — 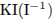 .
.
3) Определим недостающие вещества, и составим уравнение реакции с коэффициентами:

С2. Даны вещества: хлорид железа (III), оксид алюминия, гидроксид калия, пероксид водорода, иодид калия.
Напишите уравнения четырёх возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
Пояснение.
Элементы ответа:
Приведены четыре уравнения возможных реакций между указанными веществами:
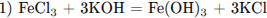
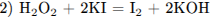
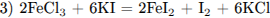
или 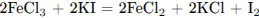
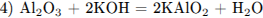 (при сплавлении)
(при сплавлении)
или 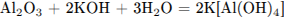
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
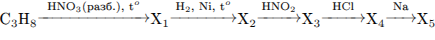
В уравнениях укажите структурные формулы органических веществ.
Пояснение.
Написаны пять уравнений реакций, соответствующих схеме превращений:
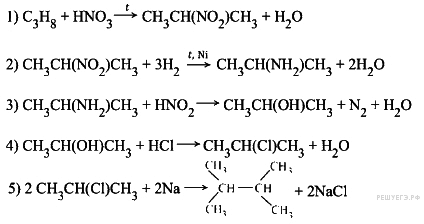
С4. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
Пояснение.
1) Записано первое уравнение реакции и найдено количество вещества образовавшейся щёлочи:
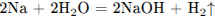
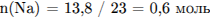
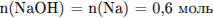
2) Найдено соотношение количества вещества основания и кислоты, записано соответствующее уравнение реакции:
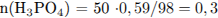
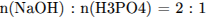
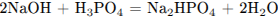
3) Вычислены массы продуктов реакций:
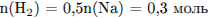
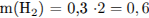
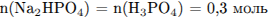
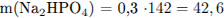
4) Вычислена массовая доля соли в растворе:
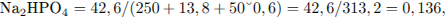 или 13,6%
или 13,6%
С5. Некоторое органическое соединение, помимо углерода и водорода, содержит азот, массовая доля которого 23,7%. Это соединение обладает нециклическим строением, взаимодействует с соляной кислотой с образованием соли, молекула его содержит два углеводородных радикала. На основании этих данных:
1) установите простейшую формулу органического соединения,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с соляной кислотой.
Пояснение.
1) простейшая формула 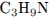
2) структурная формула
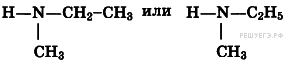
3) уравнение реакции 
Вариант 14
 2015-10-13
2015-10-13 2192
2192






