Розглянемо взаємне розташування кривих ізобарно-ізотермічного потенціалу для фаз системи при температурі Т1<TE (рис. 6, б).
Загальні дотичні до кривих для a, b і рідкої фази проходять через точки 1I і 1II (рівновага Р  a) і через точки 1III і 1IV (рівновага Р
a) і через точки 1III і 1IV (рівновага Р  b). При проектуванні вказаних точок на відповідні гілки кривих ліквідус і солідус отримуємо концентрації фаз, що знаходяться у рівновазі при T=T1.
b). При проектуванні вказаних точок на відповідні гілки кривих ліквідус і солідус отримуємо концентрації фаз, що знаходяться у рівновазі при T=T1.
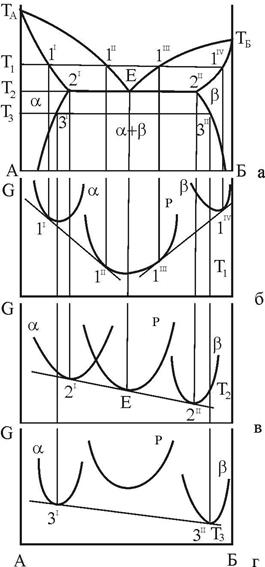
Рисунок 6 – Зв’язок кривих концентраційної залежності ізобарно-ізотермічного потенціалу з діаграмою стану з трифазною рівновагою евтектичного типу
При T=TE загальна дотична 2I-E-2II до усіх трьох кривих ізобарно-ізотермічного потенціалу показує, що усі три фази знаходяться у рівновазі. Точки дотику вказують на рівноважні концентрації кожної фази: 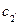 - для a-фази;
- для a-фази; 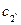 - для b-фази і
- для b-фази і 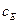 - для рідкої фази.
- для рідкої фази.
При T=T3<TE крива ізобарно-ізотермічного потенціалу для рідкої фази знаходиться вище, ніж аналогічні криві для твердих a- і b-фаз, що свідчить про нестійкість рідкої фази при низьких температурах.
Загальна дотична 3'-З" до кривих для a- и b-фаз вказує, що обидві фази знаходяться в рівновазі, причому a-фаза має склад 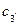 , a b-фаза -
, a b-фаза - 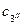 . Корисно зауважити, що будь-яка зміна складів a- і b-фаз автоматично виводе систему зі стану рівноваги, оскільки провести загальну дотичну до кривих ізобарно-ізотермічного потенціалу для a- і b-фаз інакше, ніж через точки 3' і 3", не можна. Іншими словами, для виконання умов фазової рівноваги (15):
. Корисно зауважити, що будь-яка зміна складів a- і b-фаз автоматично виводе систему зі стану рівноваги, оскільки провести загальну дотичну до кривих ізобарно-ізотермічного потенціалу для a- і b-фаз інакше, ніж через точки 3' і 3", не можна. Іншими словами, для виконання умов фазової рівноваги (15):
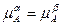
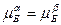
при T=T3 (див. рис. 6) склади a- і b-фаз повинні відповідати точкам 3I і 3II.
Як виходить з ходу кривих сольвус - ліній межової розчинності компонентів у a- і b-фазах зміна температури може суттєво вплинути на рівноважну концентрація фаз – рис. 7, б. Максимальна концентрація твердих розчинів, як правило, відповідає евтектичній температурі. У випадку розчинності компонентів у твердих розчинах, якою можна знехтувати, діаграма стану набуває вигляду, що показаний на рис. 7, а. у цьому випадку кажуть, що евтектика (А+Б) утворена майже чистими компонентами.
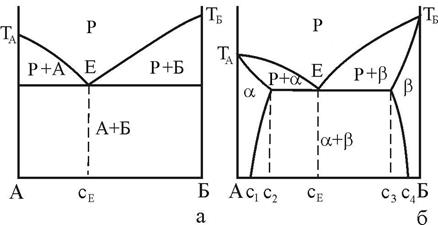
а - при відсутності розчинності компонентів у твердих фазах (гіпотетична); б – з обмеженою розчинністю компонентів у твердих фазах
Рисунок 7 – Діаграми стану з евтектичною рівновагою фаз
У деяких випадках, що залучають металічний компонент і компонент з типово ковалентним міжатомним зв’язком, наприклад, Al-Si, максимальна розчинність атомів металу у неметалевому компоненті виявляється при більш високій температурі (c1), ніж евтектична (c2) - рис. 8. У цьому випадку кажуть, що має місце ретроградна розчинність і, відповідно, ретроградний b-солідус.
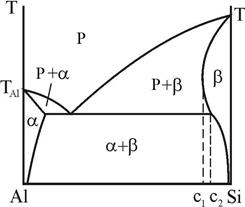
Рисунок 8 – Ретроградний b–солідус в системі Al-Si
Концентрації фаз, що знаходяться у рівновазі і їх питома кількість (об’єм і маса) визначають у відповідності з методикою, що розглянута раніше, для випадку діаграми стану з необмеженою взаємною розчинністю.
Конкретизуємо це для діаграми стану з евтектичною рівновагою, що розглядається (рис. 9).
Для сплаву складу I рівноважний стан при T=T1 характеризується двома фазами: рідкою фазою складу 1I (скорочений запис: 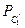 ) і b -фазою складу 1II (
) і b -фазою складу 1II (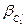 ). Співвідношення мас фаз:
). Співвідношення мас фаз:
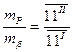 ;
; 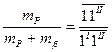 .
.
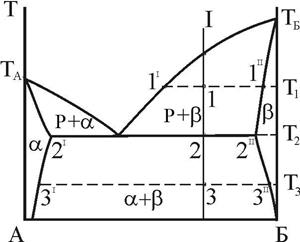
Рисунок 9 – До визначення рівноважних концентрацій фаз і співвідношення структурних складових
При евтектичній температурі (T=T2=TE) у трифазній нон варіантній рівновазі приймають участь 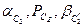 . Співвідношення мас фаз в евтектиці:
. Співвідношення мас фаз в евтектиці:
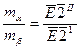 ;
; 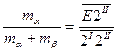
Співвідношення первинних кристалів b -фази і евтектичної складової:
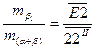 .
.
Іноді кажуть про ступінь евтектичності злитка. При цьому мають на увазі долю евтектичної складової в об’ємі злитка. Для сплаву I ступінь евтектичності (e) виражається пропорцією 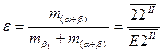 .
.
З викладеного виходить, що ступінь евтектичності наближається до одиниці при наближенні складу I до 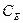 .
.
 2015-10-13
2015-10-13 557
557








