Таблица 3
Названия важнейших кислот и их средних солей
| Кислота | Название | |
| кислоты | соли | |
| HAlO2 | Метаалюминиевая | Метаалюминат |
| H3AsO4 | Мышьяковая | Арсенат |
| H3AsO3 | Мышьяковистая | Арсенит |
| HBO2 | Метаборная | Метаборат |
| H3BO3 | Ортоборная | Ортоборат |
| H2B4O7 | Четырехборная | Тетраборат |
| HBr | Бромоводородная | Бромид |
| HCOOH | Муравьиная | Формиат |
| CH3COOH | Уксусная | Ацетат |
| HCN | Циановодородная (синильная кислота) | Цианид |
| H2CO3 | Угольная | Карбонат |
| H2C2O4 | Щавелевая | Оксалат |
| HCl | Хлороводородная (соляная кислота) | Хлорид |
| HClO | Хлорноватистая | Гипохлорит |
| HClO2 | Хлористая | Хлорит |
| HClO3 | Хлорноватая | Хлорат |
| HClO4 | Хлорная | Перхлорат |
| HCrO2 | Метахромистая | Метахромит |
| H2CrO4 | Хромовая | Хромат |
| H2Cr2O7 | Двухромовая | Дихромат |
| HI | Иодоводородная | Иодид |
| HIO4 | Иодная | Периодат |
| HMnO4 | Марганцовая | Перманганат |
| NH3 | Азидоводород (азотистоводородная) | Азид |
| HNO2 | Азотистая | Нитрит |
| HNO3 | Азотная | Нитрат |
| HPO3 | Метафосфорная | Метафосфат |
| H3PO4 | Ортофосфорная | Ортофосфат |
| H4P2O7 | Двуфосфорная | Дифосфат |
| HF | Фтороводородная (плавиковая кислота) | Фторид |
| H2S | Сероводородная | Сульфид |
| HSCN | Родановодородная | Роданид |
| H2SO3 | Сернистая | Сульфит |
| H2SO4 | Серная | Сульфат |
| H2S2O7 | Двусерная | Дисульфат |
| H2SiO3 | Кремниевая | Силикат |
Таблица 4
Термодинамические константы веществ
| Вещество | Фазовое состояние | ΔН 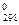 ,
кДж/моль ,
кДж/моль
| S 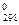 ,
Дж/моль∙К ,
Дж/моль∙К
| ΔG 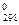 ,
кДж/моль ,
кДж/моль
|
| Cl2 | Г | 222,95 | ||
| O2 | Г | 205,03 | ||
| N2 | Г | 191,49 | ||
| H2 | Г | 130,59 | ||
| CS2 | Г | 115,28 | 237,8 | 65,9 |
| C6H6 | Г | 82,93 | 269,2 | 129,7 |
| H2S | Г | -20,15 | 206,64 | -33,8 |
| NH3 | Г | -46,19 | 192,50 | -16,71 |
| HCl | Г | -92,31 | 186,68 | -94,79 |
| CO | Г | -110,52 | 197,91 | -137,27 |
| H2O | Г | -241,83 | 188,72 | -228,59 |
| NO2 | Г | 33,0 | 240,46 | 51,84 |
| NO | Г | 90,37 | 210,2 | 86,59 |
| CO2 | Г | -393,51 | 213,65 | -394,38 |
| CH3OH | Г | -201,17 | - | - |
| C2H5OH | Г | -235,31 | 282,4 | -168,1 |
| PCl3 | Г | -287,02 | 311,66 | -260,5 |
| PCl5 | Г | -366,0 | 352,71 | -305,4 |
| C2H2 | Г | 228,75 | 200,82 | 209,20 |
| CH4 | Г | -74,85 | 186,19 | -50,79 |
| C2H6 | Г | -84,67 | 229,5 | -32,9 |
| C2H4 | Г | 52,28 | 219,45 | 68,1 |
| CH3OH | Ж | -484,1 | 126,8 | -389,4 |
| H2O | Ж | -285,84 | 69,94 | -237,19 |
| C | алмаз | 1,828 | 2,44 | 2,833 |
| C | графит | 5,69 | ||
| Fe | Т | 27,2 | ||
| Ti | Т | 30,7 | ||
| S | ромб | 31,9 | ||
| TiO2 | Т | -943,9 | 50,3 | -888,6 |
| FeO | Т | -264,8 | 54,0 | -244,3 |
| NH4Cl | Т | -316,39 | 95,8 | -203,2 |
Окончание табл.4
| Fe2O3 | Т | -822,10 | 87,4 | -740,3 |
| Ca(OH)2 | Т | -988,50 | 76,1 | -896,8 |
| Al2O3 | Т | -1669,80 | 50,92 | -1582,0 |
| BaCO3 | Т | -1219,0 | 112,0 | -1138,8 |
| CaCO3 | Т | -1206,9 | 92,9 | -1128,75 |
| Fe3O4 | Т | -1117,0 | 146,4 | -1014,2 |
| BeCO3 | Т | -982,0 | 67,29 | -944,75 |
| CaO | Т | -635,5 | 39,7 | -604,2 |
| BeO | Т | -598,0 | 14,1 | -581,61 |
| BaO | Т | -558,1 | 70,3 | -528,4 |
| NaCl | Т | -411,1 | 72,12 | -384,03 |
| ZnO | Т | -350,6 | 43,64 | -318,2 |
| PbO2 | Т | -276,6 | 74,89 | -219,0 |
| PbO | Т | -219,3 | 66,2 | -189,1 |
| Pb | Т | 64,8 | ||
| SO2 | Г | -296,9 | 248,1 | -300,2 |
| NH4NO3 | Т | -365,4 | 151,0 | -183,8 |
| SO3 | Г | -396,1 | 256,4 | -370,0 |
Таблица 5
Стандартные электродные потенциалы φ0 металлов в водных
растворах
| Электрод | Электродная реакция | φ0, В |
| Li/Li+ | Li+ + ē = Li | -3,05 |
| K/K+ | K+ + ē = K | -2,93 |
| Cs+/Cs | Cs+ + ē = Cs | -2,92 |
| Ra2+/Ra | Ra2+ + 2ē = Ra | -2,91 |
| Ba2+/Ba | Ba2+ + 2ē = Ba | -2,90 |
| Ca2+/Ca | Ca2+ + 2ē = Ca | -2,87 |
| Na+/Na | Na+ + ē = Na | -2,71 |
| La3+/La | La3+ + 3ē = La | -2,52 |
| Mg2+/Mg | Mg2+ + 2ē = Mg | -2,36 |
| Be2+/Be | Be2+ + 2ē = Be | -1,85 |
Окончание табл. 5
| Al3+/Al | Al3+ + 3ē = Al | -1,66 |
| Ti2+/Ti | Ti2+ + 2ē = Ti | -1,63 |
| V2+/V | V2+ + 2ē = V | -1,19 |
| Mn2+/Mn | Mn2+ + 2ē = Mn | -1,18 |
| Cr2+/Cr | Cr2+ + 2ē = Cr | -0,91 |
| Zn2+/Zn | Zn2+ + 2ē = Zn | -0,76 |
| Cr3+/Cr | Cr3+ + 3ē = Cr | -0,74 |
| Fe2+/Fe | Fe2+ + 2ē = Fe | -0,44 |
| Cd2+/Cd | Cd2+ + 2ē = Cd | -0,40 |
| Co2+/Co | Co2+ + 2ē = Co | -0,28 |
| Ni2+/Ni | Ni2+ + 2ē = Ni | -0,25 |
| Mo3+/Mo | Mo3+ + 3ē = Mo | -0,20 |
| Sn2+/Sn | Sn2+ + 2ē = Sn | -0,14 |
| Pb2+/Pb | Pb2+ + 2ē = Pb | -0,13 |
| W3+/W | W3+ + 3ē = W | -0,05 |
| Fe3+/Fe | Fe3+ + 3ē = Fe | -0,04 |
| 2H+/H2 | 2H+ + 2ē = H2 | 0,00 |
| Ge2+/Ge | Ge2+ + 2ē = Ge | +0,01 |
| Sb3+/Sb | Sb3+ + 3ē = Sb | +0,20 |
| Bi3+/Bi | Bi3+ + 3ē = Bi | +0,23 |
| Cu2+Cu | Cu2+ + 2ē = Cu | +0,34 |
| Cu+/Cu | Cu+ + ē = Cu | +0,52 |
| Ag+/Ag | Ag+ + ē = Ag | +0,80 |
| Hg2+/Hg | Hg2+ + 2ē = Hg | +0,85 |
| Pd2+/Pd | Pd2+ + 2ē = Pd | +0,99 |
| Pt2+/Pt | Pt2+ + 2ē = Pt | +1,20 |
| Au3+/Au | Au3+ + 3ē = Au | +1,50 |
| Au+/Au | Au+ + ē = Au | +1,70 |
Таблица 6
Константы диссоциации некоторых кислот и оснований
| Электролит | Формула | К |
| КИСЛОТЫ | ||
| Азотистая кислота | HNO2 | 4∙10-4 |
| Азотная кислота | HNO3 | 4,36∙10 |
| Борная кислота | Н3ВО3 | (I) 5,8∙10-10 (II) 1,8∙10-13 (III) 1,6∙10-10 |
| Бромноватистая кислота | HBrO | 2,1∙10-9 |
| Бромоводород | HBr | 1∙109 |
| Вода | Н2О | 1,8∙10-16 |
| Йодоводород | HI | 1∙1011 |
| Кремниевая кислота | H2SiO3 | (I) 2,2∙10-10 (II) 1,6∙10-12 |
| Муравьиная кислота | HCOOH | 1,8∙10-4 |
| Селенистая кислота | H2SеO3 | (I) 3,5∙10-3 (II) 5,0∙10-8 |
| Селеноводород | H2Sе | (I) 1,7∙10-4 (II) 1,0∙10-11 |
| Серная кислота | H2SO4 | (I) 1∙103 (II) 1,2∙10-2 |
| Сернистая кислота | H2SO3 | (I) 1,6∙10-2 (II) 6,3∙10-8 |
| Сероводород | H2S | (I) 6,0∙10-8 (II) 1,0∙10-14 |
| Теллуристая кислота | Н2ТеО3 | (I) 3,0∙10-3 (II) 2,0∙10-8 |
| Теллуроводород | Н2Те | (I) 1,0∙10-3 (II) 1,0∙10-11 |
| Угольная кислота | Н2СО3 | (I) 4,5∙10-7 (II) 4,7∙10-11 |
| Уксусная кислота | СН3СООН | 1,8∙10-5 |
| Хлорноватистая кислота | HOCl | 5,0∙10-8 |
| Хлороводород (соляная кислота) | HCl | 1,0∙107 |
| Хлоруксусная кислота | CH2ClCOOH | 1,4∙10-3 |
Окончание табл. 6
| Фосфорная кислота | Н3РО4 | (I) 7,5∙10-3 (II) 6,3∙10-8 (III) 1,3∙10-12 |
| Фтороводород (плавиковая кислота) | HF | 6,6∙10-4 |
| Циановодород | HCN | 7,9∙10-10 |
| Хромовая | H2CrO4 | (I) 1∙10 (II) 3,6∙10-7 |
| Щавелевая кислота | Н2С2О4 | (I) 5,4∙10-2 (II) 5,4∙10-5 |
| ОСНОВАНИЯ | ||
| Гидроксид алюминия | Al(OH)3 | (III) 1,38∙10-9 |
| Гидроксид аамония | NH4OH | 1,79∙10-5 |
| бария | Ba(OH)2 | (II) 2,3∙10-1 |
| железа (II) | Fe(OH)2 | (II) 1,3∙10-4 |
| железа (III) | Fe(OH)3 | (II) 1,82∙10-11 (III)1,35∙10-12 |
| лития | LiOH | 8,75∙10-1 |
| магния | Mg(OH)2 | (II) 2,5∙10-3 |
| марганца | Mn(OH)2 | (II) 5∙10-4 |
| меди (II) | Cu(OH)2 | (II) 3,4∙10-7 |
| натрия | NaOH | 5,9 |
| свинца (II) | Pb(OH)2 | (II) 9,6∙10-4 |
| стронция | Sr(OH)2 | (II) 1,5∙10-1 |
| хрома (III) | Cr(OH)3 | (III)1,01∙10-10 |
| цинка | Zn(OH)2 | (II) 4∙10-5 |
Таблица 7
Произведения растворимости некоторых труднорастворимых
электролитов (250С)
| Электролит | ПР | Электролит | ПР |
| AgBr | 5,3∙10-13 | Fe(OH)2 | 5,0∙10-16 |
| Ag2CO3 | 8,2∙10-12 | Fe(OH)3 | 4,0∙10-38 |
| AgCl | 1,8∙10-10 | FePO4 | 1,3∙10-22 |
| Ag2CrO4 | 1,1∙10-12 | FeS | 5,0∙10-18 |
| AgI | 8,3∙10-17 | HgS | 1,6∙10-52 |
| Ag2S | 6,3∙10-50 | MgCO3 | 4,0∙10-52 |
| Ag2SO4 | 1,6∙10-5 | Mg(OH)2 | 5,0∙10-12 |
| Ag3PO4 | 1,3∙10-20 | Mg3(PO4)2 | 1,0∙10-13 |
| Al(OH)3 | 5,0∙10-33 | MnCO3 | 1,8∙10-11 |
| AlPO4 | 5,7∙10-19 | Mn(OH)2 | 4,0∙10-14 |
| BaCO3 | 5,1∙10-9 | MnS | 2,5∙10-10 |
| BaCrO4 | 1,2∙10-10 | Ni(OH)2 | 2,0∙10-6 |
| BaSO4 | 1,1∙10-10 | PbBr2 | 9,1∙10-6 |
| Ba3(PO4)2 | 6,0∙10-39 | PbCO3 | 7,5∙10-14 |
| BeCO3 | 1,0∙10-3 | PbCl2 | 1,56∙10-5 |
| CaCO3 | 4,8∙10-9 | PbF2 | 2,7∙10-8 |
| CaF2 | 4,0∙10-11 | PbI2 | 1,1∙10-9 |
| CaHPO4 | 2,7∙10-7 | PbS | 2,5∙10-27 |
| Ca(H2PO4)2 | 1,0∙10-3 | PbSO4 | 1,6∙10-8 |
| CaSO4 | 9,1∙10-8 | Pb3(PO4)2 | 7,9∙10-43 |
| Ca3(PO4)2 | 2,0∙10-29 | Sb2S3 | 1,6∙10-93 |
| CdS | 7,9∙10-27 | SrCO3 | 1,1∙10-10 |
| CoCO3 | 1,4∙10-13 | SrCrO4 | 3,6∙10-5 |
| Co(OH)2 | 2,0∙10-25 | SrF2 | 2,5∙10-9 |
| α-CoS | 4,0∙10-21 | SrSO4 | 3,2∙10-7 |
| β-CoS | 2,0∙10-25 | ZnCO3 | 1,4∙10-14 |
| CrPO4 | 1,0∙10-17 | Zn(OH)2 | 5,0∙10-17 |
| CuCO3 | 1,6∙10-19 | α-ZnS | 1,6∙10-24 |
| Cu(OH)2 | 1,6∙10-19 | β-ZnS | 2,5∙10-22 |
| CuS | 6,3∙10-36 | Zn3(PO4)2 | 9,1∙10-33 |
Таблица 8
Относительные электроотрицательности элементов (по Полингу)
| I | II | III | IV | V | VI | VII | VIII | ||||
| H 2,1 | He - | ||||||||||
| Li 0,97 | Be 1,47 | B 2,01 | C 2,50 | N 3,07 | O 3,50 | F 4,10 | Ne - | ||||
| Na 1,01 | Mg 1,23 | Al 1,47 | Si 1,74 | P 2,1 | S 2,5 | Cl 2,83 | Ar - | ||||
| K 0,91 | Ca 1,04 | Sc 1,20 | Ti 1,32 | V 1,45 | Cr 1,56 | Mn 1,60 | Fe 1,64 | Co 1,70 | Ni 1,75 | ||
| Cu 1,75 | Zn 1,66 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 | Kr - | ||||
| Rb 0,89 | Sr 0,99 | Y 1,11 | Zr 1,22 | Nb 1,23 | Mo 1,30 | Te 1,36 | Ru 1,42 | Rh 1,45 | Pd 1,35 | ||
| Ag 1,42 | Cd 1,46 | In 1,49 | Sn 1,72 | Sb 1,82 | Tc 2,01 | I 2,21 | Xe - | ||||
| Cs 0,86 | Ba 0,97 | La* 1,08 | Hf 1,23 | Ta 1,33 | W 1,40 | Re 1,46 | Os 1,52 | Ir 1,55 | Pt 1,44 | ||
| Au 1,42 | Hg 1,44 | Tl 1,44 | Pb 1,55 | Bi 1,67 | Po 1,76 | At 1,90 | Rn - | ||||
| Fr 0,86 | Ra 0,97 | Ac** 1,00 |
*Лантаноиды: 1,08 – 1,14
**Актиноиды: 1,11 – 1,20
Таблица 9
| Квантовый | Магнитное квантовое число ml | Число квантовых состояний (орбиталей) | Максимальное число электронов | |||||
| уровень | подуровень | В подуровне (2l + 1) | В уровне на n2 | В подуровне (2l + 1) | В уровне на 2n2 | |||
| Обозначение | Главное квантовое число n | Обозначение | Орбитальное квантовое число l | |||||
| K | S | |||||||
| L | S | |||||||
| P | -1; 0; +1 | |||||||
| M | S | |||||||
| P | -1; 0; +1 | |||||||
| d | -2;-1; 0; +1;+2 | |||||||
| N | S | |||||||
| P | -1; 0; +1 | |||||||
| d | -2;-1; 0; +1;+2 | |||||||
| f | -3;-2;-1;0;+1;+2;+3 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
ОСНОВНАЯ
1. Ахметов, Н.С. Общая и неорганическая химия: учеб. для вузов / Н. С. Ахметов. - 7-е изд., стер. - М.: Высш. шк., 2008.
2. Глинка, Н.Л. Задачи и упражнения по общей химии: учеб. пособие / Н. Л. Глинка; под ред. В. А. Рабиновича, Х. М. Рубиной. - М.: Интеграл-Пресс, 2008.
3. Глинка,Н.Л. Общая химия: учеб. пособие для вузов / Н. Л. Глинка; под ред. А. И. Ермакова. - 13-е изд., испр. - М.: Интеграл-Пресс, 2003. -
4. Коровин, Н.В. Общая химия: учеб. для вузов / Н. В. Коровин. - М.: Высш. шк., 2009.
5. Лидин Р.А. Общая и неорганическая химия в вопросах: учеб. пособие для вузов / Р. А. Лидин, Л. Ю. Аликберова, Г. П. Логинова. - 3-е изд., стер. - М.: Дрофа, 2005.
ДОПОЛНИТЕЛЬНАЯ
1. Гуров, А.А. Химия. учеб для втузов / А.А. Гуров, Ф.З. Бадаев, Л.П. Овчаренко, В.Н. Шаповал. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2008.
2. Лидин, Р.А. Химические свойства неорганических веществ: учеб. пособие для вузов / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева; под ред. Р. А. Лидина. - 4-е изд., стер. - М.: КолосС, 2003.
3. Неорганическая химия: учеб. для вузов: В 3 т. Т. 3, кн. 2: Химия переходных элементов / А. А. Дроздов (и др.); под ред. Ю. Д. Третьякова. - 2-е изд., испр. - М.: Академия, 2008.
4. Сборник задач и упражнений по общей и неорганической химии: учеб. пособие для вузов / Н. Н. Павлов [и др.]; под ред. Н. Н. Павлова. - М.: Дрофа, 2005
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Вольхин, В.В. Общая химия. Основной курс: учеб. пособие для вузов / В. В. Вольхин. - 2-е изд., перераб. и доп. - СПб. [и др.]: Лань, 2008.
2. Гельфман, М.И. Химия: учеб. для вузов / М. И. Гельфман, В. П. Юстратов. - 4-е изд., стер. - СПб. [и др.]: Лань, 2008.
3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: учеб. пособие / З.Е. Гольбрайх, Е.И. Маслов. – М.: АСТ Астрель, 2004.
4 Горбунов, А.И. Химия: учеб. пособие для втузов / А. И. Горбунов, Г. Г. Филиппов, В. И. Федин. - М.: Изд-во МГТУ им. Н. Э. Баумана, 2007.
5. Елфимов, В.И. Основы общей химии: учеб. пособие / В. И. Елфимов, А. И. Бережной. - М.: Высш. шк., 2009.
6. Задачи предлабораторного контроля по химии: учеб.-метод. пособие / [сост. Г. А. Бурак и др.]. - Минск: Изд-во БНТУ, 2005.
7. Князев, Д.А. Неорганическая химия: учеб. пособие для вузов / Д. А. Князев, С. Н. Смарыгин. - 2-е изд., перераб. и доп. - М.: Дрофа, 2004.
8. Коржуков, Н.Г. Общая и неорганическая химия / Н.Г. Коржуков. – М.: Миссис, 2004.
9. Кудряшов, И.В. Сборник примеров и задач по физической химии: учеб. пособие для вузов / И. В. Кудряшов, Г. С. Каретников. - 7-е изд., стер. - М.: Альянс, 2008.
10. Практикум по общей и неорганической химии: учеб. пособие для вузов / В. И. Фролов [и др.]; под ред. Н. Н. Павлова, В. И. Фролова. - 2-е изд., перераб. и доп. - М.: Дрофа, 2002.
| 11. Пузаков, С.А. Сборник задач и упражнений по общей химии / С.А. Пузаков, В.А. Попков, А.А. Филиппова. – М.: Высшая школа, 2008. 12. Суворов, А.В. Общая химия: учеб. для вузов / А. В. Суворов, А. Б. Никольский. - 5-е изд., испр. - М.: Химиздат, 2007. | ||||
13. Травень В.Ф.Органическая химия: учеб. для вузов: в 2 т. / В. Ф. Травень. - М.: Академкнига, 2008. – Т.2.
| ||||
 2015-10-14
2015-10-14 413
413
 Учебно-практическое издание
УДОВЕНКО ЕЛЕНА ВАСИЛЬЕВНА ИЛЬИНА ИРИНА ВАСИЛЬЕВНА
КАЗАКОВ ОЛЕГ ГРИГОРЬЕВИЧ
ОБЩАЯ ХИМИЯ: СБОРНИК КОНТРОЛЬНЫХ ЗАДАНИЙ
Редактор издательства Т.Н. Королева
Компьютерный набор Е.В. Удовенко
Темплан 2010г., п.45
Подписано в печать 15.09.10. Формат 60х84 1/16. Бумага офсетная. Офсетная печать. Усл. печ.л. 10,46. Уч.-изд.л. 10,46. Тираж 140 экз. Заказ.
Издательство Брянского государственного технического университета
241035, г. Брянск, бульвар им. 50-летия Октября, 7, тел. 58-82-49.
Лаборатория оперативной полиграфии БГТУ, ул. Институтская, 16.
Учебно-практическое издание
УДОВЕНКО ЕЛЕНА ВАСИЛЬЕВНА ИЛЬИНА ИРИНА ВАСИЛЬЕВНА
КАЗАКОВ ОЛЕГ ГРИГОРЬЕВИЧ
ОБЩАЯ ХИМИЯ: СБОРНИК КОНТРОЛЬНЫХ ЗАДАНИЙ
Редактор издательства Т.Н. Королева
Компьютерный набор Е.В. Удовенко
Темплан 2010г., п.45
Подписано в печать 15.09.10. Формат 60х84 1/16. Бумага офсетная. Офсетная печать. Усл. печ.л. 10,46. Уч.-изд.л. 10,46. Тираж 140 экз. Заказ.
Издательство Брянского государственного технического университета
241035, г. Брянск, бульвар им. 50-летия Октября, 7, тел. 58-82-49.
Лаборатория оперативной полиграфии БГТУ, ул. Институтская, 16.







