Основные уравнения по теме:
«Протолитические реакции. Буферные растворы»
1. рKa = -lgKa - показатель константы кислотности
2. рKb =-lgKb - показатель константы основности
3. рH = -lg [H+] - водородный показатель среды
4. pOH = -lg [OH-] - гидроксильный показатель среды
5. [H+]×[OH-] = 1×10-14 - ионное произведение воды
pH + pOH = 14
6. 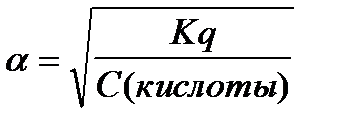 - закон разведения Оствальда
- закон разведения Оствальда
7. рH = 1/2 [pKa - lgC(1/z кислоты)] - расчет рН для растворов слабых кислот
8. pH = 14-1/2 [pKb - lgC(1/z основания)] - расчет рН для растворов слабых оснований
9. 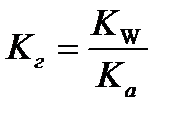 - расчёт константы гидролиза соли слабой кислоты и сильного основания
- расчёт константы гидролиза соли слабой кислоты и сильного основания
10. 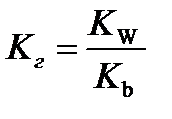 - расчёт константы гидролиза соли слабого основания и сильной кислоты
- расчёт константы гидролиза соли слабого основания и сильной кислоты
11. 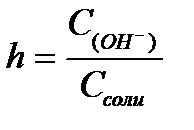 ,
, 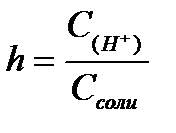 ,
, 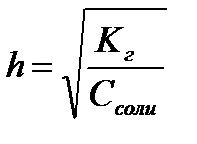 - степень гидролиза соли
- степень гидролиза соли
12. 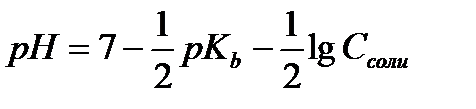 - расчёт рН раствора соли, гидролизующейся по катиону
- расчёт рН раствора соли, гидролизующейся по катиону
13. 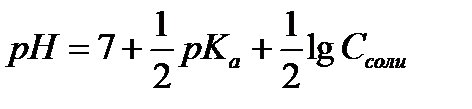 - расчёт рН раствора соли, гидролизующейся по аниону
- расчёт рН раствора соли, гидролизующейся по аниону
14. 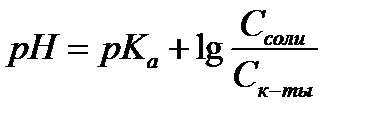 - расчет рН для буферных систем I типа
- расчет рН для буферных систем I типа
15. 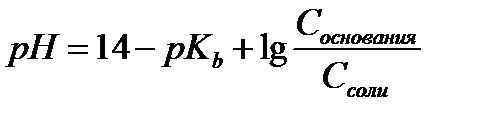 - расчет рН для буферных систем II типа
- расчет рН для буферных систем II типа
16. 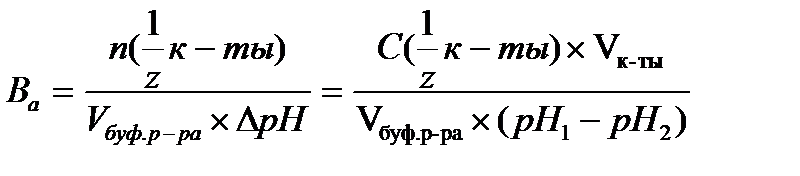 - определение буферной емкости по кислоте
- определение буферной емкости по кислоте
17. 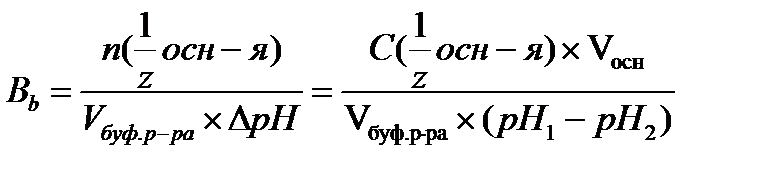 - определение буферной емкости по основанию
- определение буферной емкости по основанию
18. 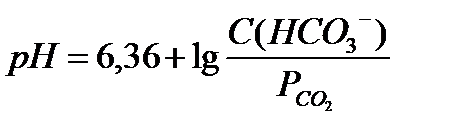 - уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы
- уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы
19. HHb + O2 + HCO3- = HbO2- + H2CO3 - суммарный процесс, протекающий в легочных капиллярах
20. HbO2- + H2CO3 = O2 + HHb + HCO3 - - суммарный процесс, протекающий в тканевых капиллярах
 2015-10-14
2015-10-14 1494
1494
