Для эффективного горения топлива необходимы определенные условия. В зависимости от условий возможно полное или частичное окисление горючих веществ. При полном окислении образующиеся продукты не могут больше соединяться с окислителем и выделять теплоту. Продуктами полного окисления горючих элементов являются полные оксиды углерода (СО 2), водорода (Н 2 О) и серы (SO 2 и в меньшей степени SО 3). Кроме того, компонентами продуктов сгорания топлива являются азот N 2, содержащийся в топливе и атмосферном воздухе, и избыточный кислород О 2, который содержится в продуктах сгорания топлива, потому что процесс горения протекает не идеально и связан с необходимостью подачи большего, чем теоретически необходимо, количества воздуха.
По уравнениям реакций окисления горючих элементов топлива, зная их молекулярную массу, плотность и объемы, можно найти массу и объем продуктов полного сгорания.
При полном сгорании углерода образуется:
С + О 2 ® СО 2;
12,01 кг С + 32,00 кг О 2 ® 44,01 кг СО 2
или 1 кг С + (32/12,01) кг О 2 ® (44,01/12,01) кг СО 2,
что соответствует
1 кг С + 2,67 кг О 2 ® 3,67 СО 2.
Для получения продуктов сгорания в объемных единицах полученную массу нужно разделить на плотность каждого газа:
1 С + (2,67/1,428) О 2 ® (3,67/1,964) СО 2 или 1 кг С + 1,866 м3 О 2 ® 1,866 м3 СО 2,
т. е. при сжигании 1 кг углерода требуется 1,866 м3 кислорода и образуется 1,866 м3 диоксида углерода.
При неполном сгорании топлива возможны два случая: не все горючие элементы окисляются; при окислении горючих элементов образуются продукты, которые могли бы участвовать в процессе горения. При неполном окислении горючих элементов могут образовываться соединения, например, по реакции
С + ½ О 2 ® СО.
12 кг С + 16 кг О 2 ® 28 кг СО; 1 кг С + 1,33 кг О 2 ® 2,33 кг СО;
1 С + (1,33/1,428) О 2 ® (2,33/1,250) СО; 1 кг С + 0,933 м3 О 2 ® 1,866 м3 СО,
т. е. при неполном сгорании 1 кг углерода требуется 0,933 м3 кислорода и образуется 1,866 м3 оксида углерода.
Неполное окисление горючих элементов связано с недостаточной подачей окислителя, неравномерным поступлением топлива и воздуха во времени, по сечению горелок или по отдельным горелкам, недостаточно хорошим перемешиванием топлива и воздуха. Наибольшее количество теплоты выделяется при полном окислении горючих элементов.
При горении серы образуется:
S + O 2 ® SO 2;
32,06 кг S + 32,00 кг О 2 ® 64,06 кг SO 2; 1 кг S + 1 кг О 2 ® 2 кг SO 2;
1 кг S + (1/1,428) О 2 ® (2/2,858) SO 2; 1 кг S + 0,7 м3 О 2 ® 0,7 м3 SO 2,
т. е. при полном сгорании 1 кг серы необходимо 0,7 м3 кислорода и образуется 0,7 м3 сернистого газа.
При окислении – горении водорода образуется:
2 Н 2 + О 2 ® 2 Н 2 О;
4,034 кг Н 2+32,00 кг О 2 ® 36,034 кг Н 2 О; 1 кг Н 2 + 8 кг О 2 ® 9 кг Н 2 О;
1 кг Н 2 + (8/1,428) кг О 2 ® (9/0,804) кг Н 2 О; 1 кг Н 2 + 5,6 м3 О 2 ® 11,2 м3 Н 2 О;
т. е. при полном сгорании 1 кг водорода требуется 5,6 м3 кислорода и образуется 11,2 м3 водяного пара.
Расход воздуха на горение определяет полноту сгорания топлива в топке котла. Минимальное количество воздуха, достаточное для полного сгорания единицы массы (объема для газа) топлива, называют теоретически необходимым количеством воздуха Vо. Учитывая, что в 1 кг топлива содержится С /100 кг углерода, Н /100 кг водорода, S /100 кг серы летучей и О /100 кг кислорода, в пересчете на рабочее топливо суммарное количество необходимого для горения кислорода, кг/кг, составляет:
 . (2.8)
. (2.8)
При нормальных условиях 1 м3 кислорода весит 1,428 кг, а в воздухе содержится около 21 % кислорода и 79 % азота. Разделив каждый из коэффициентов в выражении (2.8) на величину 1,428·0,21·100»30, можно определить количество теоретически необходимого воздуха для сгорания 1 кг твердого или жидкого топлива, м3/кг:
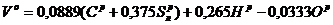 , (2.9)
, (2.9)
где С, S, Н и О – массовые доли горючих элементов и кислорода в рабочем топливе, %.
В случае сжигания газообразного топлива количество теоретически необходимого воздуха находят, исходя из стехиометрических уравнений реакций горения компонентов газообразного топлива. При этом принимают, что объем одного моля компонентов, как и у идеальных газов, одинаков. Тогда при горении:
оксида углерода
СО + 0,5 О 2 = СО 2; 1 м3 СО + 0,5 м3 О 2 = 1 м3 СО 2;
водорода
Н 2+0,5 О 2 = Н 2 О; 1 м3 Н 2+0,5 м3 О 2 = 1 м3 Н 2 О;
сероводорода
H 2 S +1,5 O 2 = H 2 O + SO 2; 1 м3 H 2 S + 1,5 м3 О 2 = 1 м3 Н 2 О + 1 м3 SO 2;
углеводородов
СmHn +(m+n /4) O 2= mCO 2 + ½ n Н 2 О; 1 м3 СmHn +(m+n /4) м3 O 2= m м3 CO 2 + ½ n м3 Н 2 О.
Таким образом, исходя из реакций полного горения составляющих газообразного топлива, следует, что каждый 1 м3 СО требует 0,5 м3 О 2 и после реакции образуется 1 м3 СО 2.
Количество теоретически необходимого воздуха для сгорания 1 м3 газообразного топлива, м3/м3:
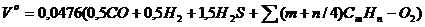 . (2.10)
. (2.10)
Для полного сгорания топлива в топочные устройства подводят большее, чем теоретически необходимо, количество воздуха. Отношение действительно поступившего количества воздуха Vд к теоретически необходимому количеству Vо называют коэффициентом избытка воздуха a:
 . (2.11)
. (2.11)
Величина коэффициента избытка воздуха зависит от типа топочных устройств и вида топлива: для газообразного топлива a колеблется от 1,05 до 1,15; для мазута – 1,03< a <1,2; для твердого топлива в пылевидном состоянии – 1,2< a <1,3; для твердого топлива, сжигаемого в слоевых топках, – 1,5< a <1,7.
При полном сгорании топлива дымовые газы содержат продукты полного окисления горючих элементов топлива – углерода, водорода и серы – СО 2, Н 2 О и SО 2; азот топлива и внесенный с воздухом N 2; неиспользованный при горении кислород воздуха О 2; водяной пар Н 2 О, полученный за счет окисления водорода топлива, испарения влаги, содержащейся в топливе, и внесенный с влажным воздухом. При паровом распыливании жидкого топлива также вносится некоторое количество Н 2 О в продукты сгорания.
Различают теоретический объем продуктов сгорания при a = 1 и действительный – при a > 1.
Полный объем продуктов сгорания твердого и жидкого топлива при коэффициенте избытка воздуха, большем единицы, м3/кг, составляет:
 . (2.12)
. (2.12)
Продукты сгорания, м3/кг, принято подразделять на сухие газы и водяные пары:
 . (2.13)
. (2.13)
При полном сгорании 1 кг углерода образуется 1,866 м3 СО 2, а 1 кг серы – 0,7 м3 SO 2, тогда при сгорании топлива объем трехатомных газов, м3/кг, составляет:
 . (2.14)
. (2.14)
При сжигании топлива с теоретически необходимым количеством воздуха (a = 1) содержание кислорода в сухих дымовых газах будет равно нулю, их объем – минимальным или теоретическим и будет состоять из объема трехатомных газов и азота (из объемов азота, содержащегося в топливе, и азота, внесенного с воздухом).
Объем азота, м3/кг, при a = 1 с учетом входящего в твердое или жидкое топливо Np /100 равен:
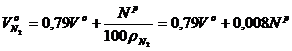 . (2.15)
. (2.15)
Последним слагаемым можно пренебречь.
Теоретический объем сухих газов, полученных от сгорания 1 кг твердого или жидкого топлива, м3/кг, составляет:
 . (2.16)
. (2.16)
Полный объем сухих газов будет больше теоретического на количество избыточного воздуха (a –1) Vо, м3/кг. Следовательно, полный объем сухих дымовых газов, м3/кг, равен:
 . (2.17)
. (2.17)
При сжигании топлив в продуктах сгорания, кроме сухих газов, содержатся водяные пары. Теоретический объем водяных паров в дымовых газах от сжигания 1 кг твердого или жидкого топлива 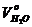 , м3/кг, равен сумме объемов водяных паров, полученных в результате окисления водорода топлива
, м3/кг, равен сумме объемов водяных паров, полученных в результате окисления водорода топлива 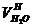 , образовавшихся при испарении влаги топлива
, образовавшихся при испарении влаги топлива  , а также влаги, содержащейся в воздухе
, а также влаги, содержащейся в воздухе  , и влаги, вносимой в топку в виде водяных паров
, и влаги, вносимой в топку в виде водяных паров  (например, для распыливания жидкого топлива через форсунки):
(например, для распыливания жидкого топлива через форсунки):
 (2.18)
(2.18)
или
 , (2.19)
, (2.19)
где 9 – количество воды, полученной при окислении 1 кг водорода, кг; 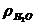 = 0,804 кг/м3 – плотность 1 кг водяных паров при нормальных условиях;
= 0,804 кг/м3 – плотность 1 кг водяных паров при нормальных условиях;  = 1,293 кг/м3 – плотность воздуха; d – количество влаги, содержащейся в воздухе, принимают 10 г на 1 кг воздуха; Wф – количество влаги, вносимой в топку в виде водяных паров, при расходе, кг/кг, топлива.
= 1,293 кг/м3 – плотность воздуха; d – количество влаги, содержащейся в воздухе, принимают 10 г на 1 кг воздуха; Wф – количество влаги, вносимой в топку в виде водяных паров, при расходе, кг/кг, топлива.
Действительный объем водяных паров в дымовых газах при сжигании твердого или жидкого топлива, м3/кг, будет больше за счет влаги, внесенной с избыточным воздухом:
 . (2.20)
. (2.20)
Полный объем продуктов сгорания твердого и жидкого топлива, м3/кг, может быть определен из выражения
 . (2.21)
. (2.21)
Состав продуктов сгорания газообразного топлива может быть найден аналогично. Пользуясь уравнениями горения для составляющих газообразного топлива, объем трехатомных газов, м3/м3, можно определить по выражению
 . (2.22)
. (2.22)
Объем азота в продуктах сгорания газа равен
 , (2.23)
, (2.23)
а объем сухих газов составляет
 . (2.24)
. (2.24)
Теоретический объем водяных паров в продуктах сгорания газа
 , (2.25)
, (2.25)
где dг.т – влажность газообразного топлива, г/м3.
Суммарный теоретический объем продуктов сгорания топлива, м3/м3, равен:
 . (2.26)
. (2.26)
Полный (действительный) объем сухих газов, м3/м3, можно определить из выражения
 , (2.27)
, (2.27)
а действительный объем, м3/м3, дымовых газов равен:
 . (2.28)
. (2.28)
В отопительных и промышленных котельных установках движение газов осуществляется за счет разрежения, создаваемого дымовой трубой или дымососом: топочное устройство и газоходы находятся под разрежением (давлением, меньшим давления атмосферного воздуха). В газоходы и топочное устройство при наличии в них отверстий и неплотностей из атмосферы поступает воздух, который называют присосом. За счет присосов избытки воздуха от топочного устройства к дымовой трубе по тракту возрастают. Величины присосов в газоходы и элементы котельной установки приведены в табл. 2.2.
В тех случаях, когда установка работает под наддувом, т. е. под давлением, несколько превышающим атмосферное, избытки воздуха по газоходам остаются постоянными и равными избытку в топке.
При небольших давлениях, порядка 3 – 4 кПа (>400 кгс/м2), или разрежениях можно считать 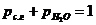 , где рс.г,
, где рс.г, 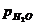 – парциальное давление соответственно сухих газов и водяных паров, кПа.
– парциальное давление соответственно сухих газов и водяных паров, кПа.
Доли трехатомных газов и водяных паров определяют по формулам:
 ;
; 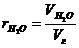 . (2.29)
. (2.29)
Масса дымовых газов при сжигании твердых и жидких топлив, кг/кг, или газообразного топлива, кг/м3, соответственно равна
 или
или  , (2.30)
, (2.30)
где  – плотность сухого газа, кг/м3, dг.т – содержание влаги в топливе, кг/м3.
– плотность сухого газа, кг/м3, dг.т – содержание влаги в топливе, кг/м3.
Суммарная объемная доля газов составляет
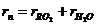 , (2.31)
, (2.31)
Концентрацию золы в дымовых газах, г/м3 или кг/м3, можно определить по формуле
 , (2.32)
, (2.32)
где аун – доля золы топлива, уносимая дымовыми газами.
Таблица 2.2
 2017-11-30
2017-11-30 5016
5016
