ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Все современные методы борьбы с коррозией можно разделить на несколько групп:
· применение электрохимических способов защиты изделий;
· использование защитных покрытий;
· проектирование и выпуск инновационных, высокоустойчивых к процессам ржавления конструкционных материалов;
· введение в коррозионную среду соединений, способных уменьшить коррозионную активность;
· рациональное строительство и эксплуатация деталей и сооружений из металлов.
Уменьшить коррозионную активность среды, окружающей металлы и сплавы, можно двумя путями:
- удалением из агрессивной среды компонентов, вызывающих коррозию металлов;
- введением в агрессивную среду специальных веществ, которые вызывают значительное снижение скорости коррозионного процесса. Такие вещества называют замедлителями, или ингибиторами, коррозии.
Обработка коррозионной среды
Обработка коррозионной среды для снижения ее агрессивности осуществляется уменьшением в ней содержания деполяризатора. В растворах электролитов это достигается путем снижения содержания ионов водорода или удаления кислорода. В кислых растворах, вызывающих коррозию с водородной деполяризацией, повышают рН раствора, т.е. уменьшают концентрацию ионов водорода. В нейтральных растворах, вызывающих коррозию с кислородной деполяризацией, снижают содержание кислорода в электролите химическим, термическим, десорбционным способами. При нагревании воды или раствора электролита вследствие уменьшения растворимости кислорода происходит его удаление из агрессивной среды. Пропускание через раствор инертного газа также способствует снижению содержания кислорода в растворе. При химической обработке воды в нее добавляют восстановители, которые связывают растворённый кислород. К таким восстановителям относятся гидразин, сульфит натрия и др.
 ;
;
 .
.
Удалить кислород из воды можно также пропусканием ее через слои железных стружек. При этом при температуре около 85°С происходит окисление железа, в результате чего кислород связывается:
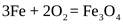 .
.
Уменьшение агрессивности газовой среды сводится к изменению ее состава и созданию атмосферы, исключающей термодинамическую возможность протекания химической реакции взаимодействия металла с компонентами газовой среды.
При воздействии на железоуглеродистые стали газов, содержащих окислители, кислород и его соединения, при высоких температурах на поверхности металла происходит реакция между цементитом и этими газами:
 .
.
В результате этой реакции поверхностный слой обедняется углеродом. Обезуглероживание ведет к изменению механических свойств: уменьшается поверхностная твердость и понижается предел усталости. При наличии водорода в газовой среде при высоких температурах и давлении наблюдается коррозия, которая резко снижает механические свойства конструкционных железоуглеродистых сталей.
Для снижения агрессивности среды в нее вводят компоненты, которые не вызывают окисления, обезуглероживания и наводороживания. Расчет состава защитной атмосферы для металлов и сплавов проводят с использованием констант равновесия, устанавливающихся в системе металл-газ. Для создания защитных атмосфер разработано несколько газовых смесей:
— водород-водяной пар-азот;
— водород-водяной пар-оксид углерода-азот;
— водород-водяной пар-азот-оксид углерода-диоксид углерода;
— азот-оксид углерода-водород.
Иногда термическую обработку нержавеющих сталей проводят в вакууме или в атмосфере аргона.
Для снижения скорости атмосферной коррозии металла изделия помещают в герметичные чехлы из полиэтиленовой пленки, внутри которых создают атмосферу с относительной влажностью воздуха ниже критической (60%) за счет применения осушителей (силикагель). В искусственно созданной сухой атмосфере коррозионные процессы протекают очень медленно.
Ингибиторы коррозии
Замедлителями, или ингибиторами, коррозии называют вещества, введение небольших количеств которых в коррозионную среду значительно снижает скорость коррозии.
Уменьшение электрохимической коррозии при введении замедлителя может произойти вследствие торможения анодного или катодного процесса, воздействия на оба процесса или увеличения сопротивления системы при образовании на металлической поверхности пленки, обладающей пониженной электропроводностью.
Один из методов изучения механизма действия замедлителей коррозии - построение поляризационных кривых. Торможение ингибитором одной из стадий коррозионного процесса вызывает увеличение поляризации соответствующего процесса. Сравнение поляризационных кривых, полученных для данного металла в растворе с ингибитором и без него, позволяет выяснить, какой процесс преимущественно тормозится при введении данного замедлителя. По составу ингибиторы коррозии подразделяются на неорганические и органические.
По условиям, в которых они применяются, их можно разделить на ингибиторы для растворов и летучие ингибиторы, дающие защитный эффект в условиях атмосферной коррозии. Так как эффективность действия ингибитора зависит от рН среды, то ингибиторы подразделяются на кислотные, щелочные и ингибиторы для нейтральных сред. Замедлители наиболее часто применяют для борьбы с коррозией в системах с ограниченным объемом раствора и с атмосферной коррозией металла. Замедлители кислотной коррозии находят широкое применение в процессах удаления с изделий окалины или ржавчины.
По механизму своего действия на процесс электрохимической коррозии ингибиторы подразделяют на анодные, катодные и экранирующие, т. е. изолирующие активную поверхность металла. Механизм действия большинства ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности с последующим торможением катодных и анодных процессов.
Анодные ингибиторы коррозии (в первую очередь окислители) большей частью обладают пассивирующими свойствами. Принцип торможения коррозии анодными замедлителями сводится к снижению скорости перехода ионов металла в раствор или к уменьшению площади анодных участков коррозионного элемента за счет изоляции их образовавшимися нерастворимыми пленками.
Как видно из рисунка, в результате введения ингибитора коррозии сила коррозионного тока падает с величины i1 до величины i2, при этом наблюдается тенденция к облагораживанию стационарного электродного потенциала металла, т. е. смещение его в сторону положительных значений, от Е1 к Е2.
Такие окислители, как хроматы и бихроматы, сильно пассивируют железо, алюминий, цинк, медь. Достаточно добавить в водопроводную воду 0,1% бихромата калия, чтобы резко снизить скорость коррозии углеродистой стали и алюминия.
К анодным ингибиторам относятся также нитриты и нитраты. Нитрит натрия значительно уменьшает скорость коррозии стали в растворах ряда солей, а также в морской воде. При необходимости длительного хранения стальных деталей их рекомендуется упаковывать в бумагу, пропитанную 10-15% раствором нитрита натрия.
Известны также анодные ингибиторы коррозии вторичного действия, образующие на анодных участках корродирующей поверхности металла нерастворимые продукты коррозии с ингибитором. К числу таких замедлителей коррозии углеродистой стали относятся гидроксид натрия, карбонат натрия, которые образуют на поверхности нерастворимый слой гидроксида, а также фосфатные соли, которые, в свою очередь, образуют нерастворимые фосфаты железа.
Однако анодные замедлители коррозии - окислители в некоторых случаях (например, при низкой концентрации ингибитора) могут стимулировать коррозионный процесс, становясь катодными ускорителями коррозии.
Катодные замедлители уменьшают скорость электрохимической коррозии за счет снижения интенсивности катодного процесса или сокращения площади катодных участков.
Торможение катодного процесса основано на снижении содержания кислорода в растворе электролита с целью уменьшения скорости коррозии металла с кислородной деполяризацией, или на затруднении протекания катодного процесса. К числу катодных ингибиторов относятся следующие:
— Катодные замедлители - поглотители кислорода. Их действие основано на уменьшении содержания кислорода в растворе и, следовательно, снижении скорости коррозии с кислородной деполяризацией. К ним относятся сульфит натрия, гидразин и др.
— Катодные замедлители, повышающие перенапряжение выделения водорода при катодной реакции. В процессах коррозии металлов, протекающих с водородной деполяризацией, торможение катодной реакции восстановления водорода достигается путем повышения перенапряжения выделения водорода при добавлении в раствор солей некоторых тяжелых металлов (соли висмута, сурьмы), катионы которых, восстанавливаясь на катодных участках, повышают перенапряжение выделения водорода.
— Катодные замедлители, экранирующие площадь катодных участков.
Сокращение площади катодных участков достигается образованием нерастворимых соединений в виде изолирующего защитного слоя. По отношению к железу такими замедлителями являются бикарбонат кальция, сульфат цинка, хлорид бария:
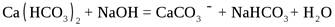 .
.
Выделяющийся на катодных участках нерастворимый карбонат кальция экранирует металл. Органические ингибиторы, адсорбируясь на катодных участках поверхности, также повышают перенапряжение выделения водорода (желатин, клей, декстрин и др.).
Катодные замедлители коррозии металлов совершенно безопасны, так как они никогда не приводят к увеличению скорости коррозии.
В последние годы широко применяются летучие, или парофазные, ингибиторы, которые используются для защиты машин, аппаратов и других металлических изделий во время их эксплуатации в воздушной атмосфере. Летучие ингибиторы вводятся в контейнеры или в упаковочные материалы. Благодаря достаточно высокому давлению паров летучие ингибиторы достигают границы раздела металл - воздух и растворяются в пленке влаги, покрывающей металл. В качестве летучих ингибиторов обычно используются амины с небольшой молекулярной массой, в которые вводятся нитраты или карбонаты.
Недостатком летучих ингибиторов коррозии является прекращение их защитного действия после удаления их паров из атмосферы, окружающей металл.
На производственных предприятиях с коррозией можно с успехом справляться посредством модификации состава агрессивной атмосферы, в которой работают металлические детали и конструкции. Существует два варианта снижения агрессивности среды:
· введение в нее ингибиторов (замедлителей) коррозии;
· удаление из среды тех соединений, которые являются причиной возникновения коррозии.

Ингибиторы, как правило, используются в системах охлаждения, цистернах, ваннах для выполнения травильных операций, различных резервуарах и прочих системах, в коих коррозионная среда имеет примерно постоянный объем. Замедлители подразделяют на:
· органические, неорганические, летучие;
· анодные, катодные, смешанные;
· работающие в щелочной, кислой, нейтральной среде.
Ниже указаны самые известные и часто используемые ингибиторы коррозии, которые отвечают требованиям СНиП для разных производственных объектов:
· бикарбонат кальция;
· бораты и полифосфаты;
· бихроматы и хроматы;
· нитриты;
· органические замедлители (многоосновные спирты, тиолы, амины, аминоспирты, аминокислоты с поликарбоксильными свойствами, летучие составы "ИФХАН-8А", "ВНХ-Л-20", "НДА").
Легирование железа такими металлами, как никель, хром, марганец, кремний, алюминий, молибден, вольфрам, позволяет повысить коррозионную устойчивость металла за счет образования на его поверхности коррозионностойкой оксидной пленки.
По составу сплавы железа подразделяются на низколегированные (до двух процентов легирующих компонентов) и высоколегированные, когда железо легируют одним или несколькими легирующими компонентами (общее содержание легирующих компонентов свыше 15%), например, нержавеющая сталь 12Х18Н10Т.
Теория коррозионностойкого легирования металлов, устойчивых к электрохимической коррозии, основывается на учении о контролирующих факторах коррозии - омическом, катодном и анодном торможении процесса коррозии. На основе этих факторов разработаны три направления повышения коррозионной устойчивости сплавов:
1. Создание сплавов, образующих более совершенный защитный слой продуктов коррозии на своей поверхности. В металл вводят компоненты, способствующие образованию плотной защитной пленки на поверхности металла. Торможение коррозии достигается как за счет увеличения омического сопротивления, так и за счет экранирующего слоя, тормозящего доставку к металлической поверхности веществ, необходимых для протекания катодного процесса или удаление продуктов электродной реакции. Например, при легировании железа медью наступает пассивное состояние железа, но этот метод имеет ограниченное применение, так как при электрохимической коррозии трудно достичь полного экранирования поверхности.
2. Уменьшение катодной активности металлов. Защитные свойства металлов повышаются вследствие уменьшения площади микрокатодов или увеличения перенапряжения выделения водорода на микрокатодах, т. е. происходит торможение катодного процесса. При легировании железа сурьмой, висмутом, мышьяком увеличивается перенапряжение выделения водорода.
3. Снижение анодной активности металлов. Защитные свойства металлов повышаются в результате уменьшения активности анодной фазы путем введения компонентов, повышающих или термодинамическую устойчивость сплава, или его пассивность. Повышение коррозионной стойкости, например, стали, достигается легированием ее хромом, хромом и никелем, хромом, никелем и небольшими добавками палладия.
Какой из приведенных методов повышения коррозионной устойчивости сплавов надежнее и перспективнее, можно определить исходя из конкретных условий. При кислотной коррозии в восстановительных средах с выделением водорода и в отсутствии возможности повышения склонности к пассивированию весьма полезными могут оказаться методы уменьшения катодной активности сплавов или повышения термодинамической устойчивости анодной фазы. В условиях возможности установления пассивного состояния, наоборот, совершенно не эффективны методы снижения катодной активности, а окажутся полезными все методы, снижающие анодную активность сплавов.
При возможности установления пассивного состояния сплава эффективен метод введения активных катодов. Однако этот метод окажется вредным, если по условиям коррозии (восстановительная среда, наличие ионов хлора) установление стойкого пассивного состояния невозможно.
Повышение коррозионной стойкости металлов в кислотах достигается кислотостойким легированием. Коррозия металлов в кислотах с неокисляющимся анионом (разбавленная серная кислота, соляная кислота) протекает, в основном, с водородной деполяризацией. При коррозии в окисляющих кислотах (азотная кислота, концентрированная серная кислота) основным катодным процессом является восстановление аниона кислоты.
Коррозионную стойкость сплавов в окисляющих кислотах можно повысить, вводя легко пассивирующиеся металлы, например, хром. Сталь, легированная хромом, имеет повышенную стойкость в азотной кислоте. Стойкость металлов в кислотах, в которых возможно наступление пассивного состояния, повышается также в результате легирования металлами, являющимися эффективными катодами. Так, легирование стали типа Х18Н10 палладием повышает стойкость сплава в серной кислоте.
Для повышения коррозионной стойкости в неокисляющих кислотах сплавы легируют молибденом и медью. Кислотостойкость молибдена объясняется его склонностью к пассивированию и образованию защитных пленок. Кислотостойкость меди связана с ее термодинамической устойчивостью в условиях коррозии с водородной деполяризацией. При коррозии легированных медью сплавов их поверхность обогащается медью вследствие ее более высокой коррозионной стойкости.
 2017-10-25
2017-10-25 4344
4344