| Сравнительная характеристика | Все галогены (кроме F) могут иметь степень окисления: -1; 0; +1; +3; +5; +7 (F-1 !) | Галогеноводороды НГ | |||||||||||||||
Простые вещества F2, Cl2, Br2, I2  Уменьшение окислительных свойств, т.к. уменьшается радиус атома, следовательно, уменьшается способность присоединять е- Г2 + 2 е- → 2 Г-1 Уменьшение окислительных свойств, т.к. уменьшается радиус атома, следовательно, уменьшается способность присоединять е- Г2 + 2 е- → 2 Г-1 | Кислородные соединения хлора
усиление кислотных свойств кислородсодержащих кислот | Химические свойства I. Качественная реакция: Ag+ + Г- → AgГ↓ (AgCl – белый творожистый AgBr – желтовато-белого цвета AgI – ярко желтого цвета) II. Типичные свойства кислот HCl→ H+ + Cl- HCl + NaOH→NaCl + H2O 2HCl +MgO→MgCl2 + H2O 2HCl +Fe→FeCl2 + H2 2HCl+Na2CO3→2NaCl + H2O+CO2 III. Специфические свойства HF – слабая кислота (образует ассоциаты за счет H-связи (HF)4 4HF + SiO2 → SiF4↑ + 2H2O (оксид кремния входит в состав стекла, поэтому HF хранят в сосудах из пластмассы, каучука, тефлона).     HF + Г; NaF + Г HF + Г; NaF + Г 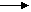  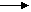  HCl + Br2 (I2); HBr + I2 2HCl + F2 → 2HF + Cl2 2HBr + Cl2 → 2HCl + Br2 2HBr + F2 → 2HF + Br2 2HI + Г2 → 2HГ + I2 Более сильный окислитель вытесняет менее сильный из соединений. HCl + Br2 (I2); HBr + I2 2HCl + F2 → 2HF + Cl2 2HBr + Cl2 → 2HCl + Br2 2HBr + F2 → 2HF + Br2 2HI + Г2 → 2HГ + I2 Более сильный окислитель вытесняет менее сильный из соединений. | |||||||||||||||
| F2 -газ светло-зеленого цв. Cl2 - газ желто-зеленого цв. Br2-красно-бурая жидкость J2-темно-фиолет.кристаллы с металлическим блеском | Химические свойства хлора 1. С простыми веществами: - 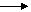 Cl2 + H2 hν 2HCl - Cl2 + 2Na → 2NaCl - 3Cl2 + 2Fe → 2FeCl3 - 3Cl2 + 2P → 2PCl3 - Cl2 + H2 hν 2HCl - Cl2 + 2Na → 2NaCl - 3Cl2 + 2Fe → 2FeCl3 - 3Cl2 + 2P → 2PCl3 -  Cl2 + S → SCl2 - Cl2 + S → SCl2 -  Cl2 + O2 2. Со сложными веществами: - Cl2 + H2O ↔ HCl + HClO Cl2 + O2 2. Со сложными веществами: - Cl2 + H2O ↔ HCl + HClO  HClO hν HCl + [O] окисляющее, отбеливающее, дезинфицирующее. - HClO hν HCl + [O] окисляющее, отбеливающее, дезинфицирующее. -   Cl2 + кислоты - Cl2 + кислоты -  Cl2 + 2NaOH холод NaCl + NaClO + H2O - Cl2 + 2NaOH холод NaCl + NaClO + H2O -  3Cl2 + 6KOH t 5KCl + KClO3 + 3H2O - CO + Cl2 3Cl2 + 6KOH t 5KCl + KClO3 + 3H2O - CO + Cl2  hν COCl2 фосген 3. С органическими веществами. hν COCl2 фосген 3. С органическими веществами. | ||||||||||||||||
Ионы галогенов Способны отдавать е- Могут быть восстановителями. F-1 – не может быть восстановителем, не имеет положительной степени окисления. Cl-1, Br-1, I-1
увеличение восстановительных свойств Cl-1 - 8 е- → Cl+7 | |||||||||||||||||
| Водные растворы НГ – кислоты HF → HCl → HBr → HI усиление кислотных свойств (т.к. увеличивается радиус элементов; связь между Н-Г ослабевает, диссоциация возрастает) | Получение хлора I. В промышленности: 1.  2NaCl + 2H2O эл-з Cl2 + H2 + 2NaOH 2. 2NaCl + 2H2O эл-з Cl2 + H2 + 2NaOH 2.  2NaCl эл-з Cl2 + 2Na II. В лаборатории (действие концентрированной соляной кислоты на различные окислители): 1. 2NaCl эл-з Cl2 + 2Na II. В лаборатории (действие концентрированной соляной кислоты на различные окислители): 1.  4HCl к. + MnO2 t MnCl2 + Cl2 + 2H2O 2. 4HCl к. + MnO2 t MnCl2 + Cl2 + 2H2O 2.  KClO3 + 6HClк. t KCl + 3Cl2 + 3H2O 3. 2KMnO4 + 16HCl к. → 2KCl + 2MnCl2 + 5Cl2 + 8H2O KClO3 + 6HClк. t KCl + 3Cl2 + 3H2O 3. 2KMnO4 + 16HCl к. → 2KCl + 2MnCl2 + 5Cl2 + 8H2O | Получение HГ I. H2 + Cl2 → 2HCl II. NaClтв. + H2SO4к → HCl↑ + NaHSO4 (Na2SO4) Аналогичным способом можно получить HF, но нельзя HBr, HI, т.к. они являются сильными восстановителями и окисляются серной кислотой до свободных Br2 и I2. |
 2017-12-14
2017-12-14 1529
1529








