Способи добування
Взаємодія алкоголятів і фенолятів з галогеналканами:
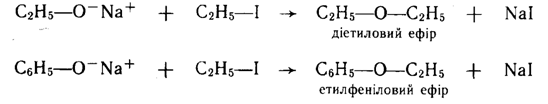
Міжмолекулярна дегідратація спиртів. При нагріванні спиртів у присутності концентрованої H2SО4або інших водовіднімаючих засобів утворюються прості ефіри:
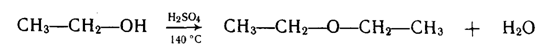
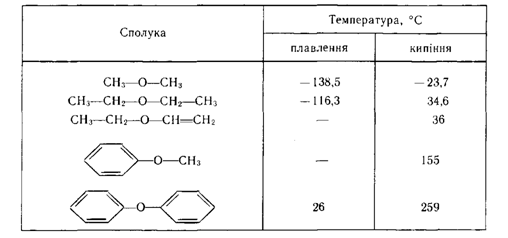
Фізичні властивості
Діалкілові ефіри — це безбарвні рідини зі своєрідним «ефірним» запахом і відносно низькими у порівнянні з відповідними спиртами температурами кипіння. Алкіларилові та діарилові ефіри є безбарвними рідинами або кристалічними речовинами з приємним запахом (табл.). Молекули простих ефірів не утворюють міжмолекулярні водневі зв'язки.
Фізичні характеристики деяких простих ефірів
Хімічні властивості
У хімічному відношенні прості ефіри є досить інертними речовинами. Розведені мінеральні кислоти та луги на холоду з ними не реагують. За рахунок наявності на атомі кисню неподілених пар електронів, прості ефіри виявляють слабкі основні властивості. Під дією йодоводневої та концентрованої сірчаної кислот прості ефіри піддаються розщепленню. Реакційна здатність вінілових і арилових ефірів зумовлена наявністю вуглеводневого радикала.
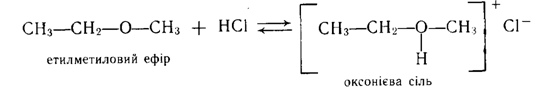
Утворення оксоніевих солей. Концентровані мінеральні кислоти (НС1, H2SО4, НNО3 та ін.) утворюють з простими ефірами оксонієві солі. Протон кислоти приєднується до кисню ефіру за рахунок неподіленої пари електронів атома кисню:
Реакція розщеплення простих ефірів (ацидоліз):
1. Реакція з йодоводневою кислотою. Прості ефіри розкладаються концентрованою НІ вже на холоду з утворенням алкіл-йодиду та спирту:
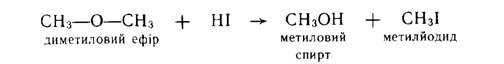
Реакція розщеплення диметилового ефіру НІ проходить за механізмом SN2 та починається з утворення оксонієвого іона, котрий потім піддається атаці нуклеофілом:
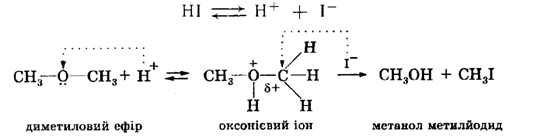
Якщо реакція ведеться при нагріванні, то утворюється друга молекула метилйодиду:
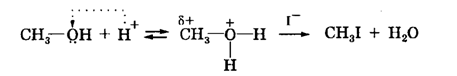
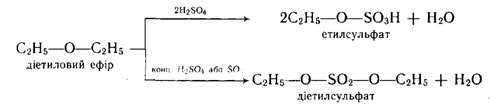
2. Реакція з концентрованою сірчаною кислотою. Взаємодія з концентрованоюH2SO4 приводить до розщеплення простих ефірів. Реакція проходить або за механізмомSN2 (ефіри первинних спиртів), або за механізмомSN1 (ефіри третинних спиртів) та приводить до утворення складних ефірів сірчаної кислоти:
Окислення простих ефірів. При тривалому стоянні на повітрі прості ефіри окислюються з утворенням вибухонебезпечних гідропероксидівR—О—ОН і пероксидівR—О—О—R. Тому перегонку ефірів не можна вести досуха через небезпеку вибуху. Для руйнування пероксидів ефір обробляють відновлювачем, який розкладає пероксид. Зберігають вільні від пероксидів ефіри над металічним натрієм або гідридом кальцію.
Окремі представники
Діетиловий ефір (етоксіетан) C2H5—О—С2Н5. Безбарвна, летка, легкозаймиста рідина зі специфічним запахом (т. кип. 36,5°С), яка утворює з повітрям вибухову суміш. Змішується з більшістю органічних розчинників, не змішується з водою, значно легший останньої. Широко застосовується як розчинник. Важливе застосування знайшов у медицині як препарат для загального наркозу. При дії сонячного світла на повітрі він легко окислюється з утворенням оцтового альдегіду, гідропероксиду (СН3—СНОН—ООН), пероксиду (СН3—СНОН—О—О—СНОН—СН3) та інших досить отруйних речовин, присутність яких неприпустима в ефірі для наркозу.
 2017-12-14
2017-12-14 870
870






