Молярна маса еквівалентів кислоти (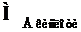 ) – відношення молекулярної маси кислоти (МК) до основності, яка визначається кількістю атомів Гідрогену, що беруть участь у реакції:
) – відношення молекулярної маси кислоти (МК) до основності, яка визначається кількістю атомів Гідрогену, що беруть участь у реакції:
 , (г/моль). (1.3)
, (г/моль). (1.3)
Для реакції H2SO4 + 2NaOH = Na2SO4 + 2H2O
МЕ(H2SO4) = М(Н2SO4)/2 = 98/2 = 49 г/моль,
а для реакції H2SO4 + NaOH = NaНSO4 + H2O
МЕ(H2SO4) = М(Н2SO4)/1 = 98/1 = 98 г/моль.
Молярна маса еквівалентів основи ( ) – відношення молекулярної маси основи (МО) до кислотності, яка визначається кількістю гідроксогруп, що вступають у реакцію:
) – відношення молекулярної маси основи (МО) до кислотності, яка визначається кількістю гідроксогруп, що вступають у реакцію:
 (г/моль). (1.4)
(г/моль). (1.4)
Наприклад, МЕ(Сa(OH)2) = М(Сa(OH)2)/2 = 74/2 = 37 г/моль.
Молярна маса еквівалентів солі (МЕ) – відношення молекулярної маси солі (МС) до добутку кількості атомів металу, що вступають у реакцію, на їх валентність:
 (г/моль), (1.5)
(г/моль), (1.5)
де  – кількість атомів металу. Наприклад,
– кількість атомів металу. Наприклад,
МЕ(Al2(SO4)3) = М(Al2(SO4)3)/( )= 342/(2·3) = 57 г/моль.
)= 342/(2·3) = 57 г/моль.
Молярна маса еквівалентів оксиду ( ) обчислюється за формулою:
) обчислюється за формулою:
 (г/моль), (1.6)
(г/моль), (1.6)
де  – число атомів металу (неметалу) у молекулі.
– число атомів металу (неметалу) у молекулі.
Наприклад, МЕ(Al2O3) = (Al2O3)/(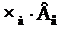 )=102/(2·3) = 17 г/моль,
)=102/(2·3) = 17 г/моль,
Молярну масу еквівалентів оксиду також можна обчислити як суму молярних мас еквівалентів елемента і Оксигену.
Наприклад, МЕ(Al2O3) = ME(Al) + ME(O) = 9 + 8 = 17 г/моль.
Для газоподібних речовин користуються молярними об’ємами еквівалентів (VЕ). VЕ(Н2) = 11,2 л/моль, VЕ(О2) = 5,6 л/моль, VЕ(Сl2) = 11,2 л/моль.
За законом еквівалентів:
1. Хімічні елементи сполучаються один з одним, а речовини реагують і утворюються в еквівалентних кількостях.
2. Маси (об’єми) речовин, що реагують, пропорційні молярним масам (об’ємам) їхніх еквівалентів:

 . (1.7)
. (1.7)
Якщо одна з реагуючих речовин газоподібна, то у формулі закону еквівалентів замість маси використовують її об’єм (н.у.) та молярний об’єм еквівалентів:
 . (1.8)
. (1.8)
Розділ 1.3. Будова атома
Атом – електронейтральна мікросистема, що складається з позитивно зарядженого ядра та негативно заряджених електронів. Ядра атомів складаються з двох типів мікрочастинок (нуклонів) –протонів  і нейтронів
і нейтронів  . Електрон прийнято розглядати одночасно і як мікроматеріальну частинку, і як хвилю. Подвійність властивостей електрона виявляється у тому, що він, з одного боку, має властивості частки (має певну масу спокою m), а з іншого боку – його рух нагадує хвилю. Із поняття подвійної природи електрона випливає важливий висновок, відомий під назвою принципу невизначеності Гейзенберга: мікрочастинка (електрон), так само як і електронна хвиля, не має одночасно точних значень координат та імпульсу (m∙υ). Цей принцип виявляється у тому, що чим точніше визначаються координати частинки, тим більш невизначеним стає її імпульс (або пов’язана з ним швидкість частинки υ), і навпаки. Тому не можна говорити про визначену траєкторію руху електрона – можна лише судити про ймовірність його перебування у певній ділянці простору.
. Електрон прийнято розглядати одночасно і як мікроматеріальну частинку, і як хвилю. Подвійність властивостей електрона виявляється у тому, що він, з одного боку, має властивості частки (має певну масу спокою m), а з іншого боку – його рух нагадує хвилю. Із поняття подвійної природи електрона випливає важливий висновок, відомий під назвою принципу невизначеності Гейзенберга: мікрочастинка (електрон), так само як і електронна хвиля, не має одночасно точних значень координат та імпульсу (m∙υ). Цей принцип виявляється у тому, що чим точніше визначаються координати частинки, тим більш невизначеним стає її імпульс (або пов’язана з ним швидкість частинки υ), і навпаки. Тому не можна говорити про визначену траєкторію руху електрона – можна лише судити про ймовірність його перебування у певній ділянці простору.
Електронна орбіталь – невизначена лінія переміщення електрона, а деяка частина простору навколо ядра, у межах якого ймовірність перебування електрона найбільша. Електронна орбіта не характеризує послідовність переміщення електрона від точки до точки, а визначається ймовірністю перебування електрона на визначеній відстані від ядра. Електронна хмара не має різко обкреслених меж. Математичний опис електронної орбіталі можливий лише за умови цілком визначених дискретних значень певних характеристик електрона, які називають квантовими числами: головним (n), орбітальним (l), магнітним (m l) і спіновим (ms).
1. Головне квантове число n характеризує величину енергії електрона і може приймати тільки позитивні цілочисельні значення: 1, 2, 3 та ін. Зі збільшенням головного квантового числа енергія електрона зростає. Стан електрона, що відповідає певному значенню головного квантового числа, називають енергетичним рівнем електрона в атомі. Крім енергії електрона головне квантове число визначає розміри електронної хмари: чим вище значення головного квантового числа, тим більша електронна хмара (електронний шар). Електронні шари позначають великими буквами латинського алфавіту K, L, M, N, O, причому K шар є першим від ядра атома, йому відповідає головне квантове число n = 1, L шар – другим, M шар – третім і ін. Зі збільшенням головного квантового числа змінюються число і характер електронних орбіталей у межах даного електронного шару. Максимальна кількість електронів N у даному електронному шарі, описується формулою: N = 2n2.
2. Орбітальне квантове число l описує форму електронної хмари і може приймати будь-які цілочисельні значення від 0 до (n–1). Відповідні орбіталі позначаються малими літерами латинського алфавіту: s (l = 0), p (l = 1), d (l = 2), f (l = 3). Орбітальне квантове число відображає енергію електрона на підрівні. Електрони з різними орбітальними квантовими числами трохи відрізняються один від одного: їхня енергія тим вище, чим більше число l. Число можливих підрівнів у кожному енергетичному рівні збігається з порядковим номером електронного шару, але фактично жоден енергетичний рівень не містить більше чотирьох підрівнів. Це справедливо для стаціонарного стану атомів всіх елементів. Так, першому енергетичному рівню відповідає s-підрівень; другому рівню – два підрівня: s і p; третьому рівню – три підрівня: s, p і d; четвертому і наступним – чотири підрівня: s, p, d і f.
3. Магнітне квантове число ml визначає орієнтацію орбіталей у просторі. Магнітне квантове число ml може приймати цілочисельні значення від – l до + l, у тому числі нульове значення. Воно визначає число орбіталей у електронному шарі: s-підрівень (ml = 0), 3p-підрівень містить три орбіталі:
| р-підрівень |
ml –1 0 +1
d-підрівень містить п’ять орбіталей
| d-підрівень |
ml –2 –1 0 +1 +2
f-підрівень містить сім орбіталей
| f-підрівень |
ml –3 –2 –1 0 +1 +2 +3
Орбіталі з різними магнітними квантовими числами, але з однаковим головним і орбітальним квантовими числами, характеризуються однієї і тією же енергією. ml –вектор, якому відповідає визначене числове значення і визначений напрямок, що виражається в знаках "+" і "–".
4. Спінове квантове число ms раніш зв’язували з напрямком обертання електрона навколо своєї осі, але тепер його вважають чисто квантово-механічною величиною. Спін електрона може мати два значення: +½ і –½.
Основні принципи розподілу електронів в атомі
Електронна оболонка атома заповнюється електронами у відповідності наступним правилам.
1. Принцип найменшої енергії: електрон в атомі займає той вільний підрівень, на якому він має мінімальне значення енергії. Тобто, електрон залишається на тому підрівні, на якому забезпечується найбільш міцний зв’язок з ядром. Конкретна реалізація цього принципу відображується правилами Клечковського:
1) Заповнення електронних шарів відбувається в порядку збільшення сум головного й орбітального квантових чисел (n + l). Так, сума (n + l) для електронів 3d-орбіталі дорівнює 5 (n =3, l= 2), для електронів 4s-орбіталі – 4 (n = 4, l = 0). Тому спочатку електронами заповнюється 4s-орбіталь, а потім 3d-орбіталь.
2) Якщо для двох орбіталей суми (n + l) мають однакові значення, то спочатку електронами заповнюється орбіталь з меншим значенням головного квантового числа. Наприклад, для електронів 3d- і 4p-орбіталей сума n + l = 5 (відповідно 3 + 2 і 4 + 1). Але тому, що для електронів 3d-орбіталі головне квантове число n = 3, а для електронів 4p-орбіталі n = 4, у першу чергу заповнюються 3d-орбіталі. Лише після того, як заповнені орбіталі менших енергій, починається заповнення орбіталей більших енергій. Для енергетичних підрівнів збільшення енергії відбувається приблизно таким чином:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f≈5d <6p<7s<5f≈6d<7p.
Зазначимо, що дана послідовність не відображує окремих особливостей електронної будови атомів деяких елементів. Наприклад, в атомах Лантана (№ 57) починається заповнення 5d-підрівня, замість 4f:
57La 1s22s22p63s23p63d104s24p64d10 5s25p65d16s2.
А у наступних за Лантаном 14 елементів (Се–Lu) енергетично більш вигідний 4f-стан у порівнянні з 5d. Тому у цих елементів відбувається заповнення спочатку 4f-підрівнів:
58Се 1s22s22p63s23p63d104s24p64d10 4f25s25p66s2.
У сьомому періоді за двома s-елементами (Fr, Ra) слідує d-елемент Ас і чотирнадцять f-елементів (Th–Lr), далі – знову d-елементи. Порушення „нормального” порядку заповнення енергетичних рівнів в атомах Лантана й Церія й аналогічні особливості в електронній будові атомів елементів сьомого періоду пояснюється наступним чином. При збільшенні заряду ядра електростатичне притягнення до ядра електрона, який знаходиться на даному енергетичному підрівні, стає більш сильним, і енергія електрона зменшується. При цьому енергія електронів на різних підрівнях змінюється не однаково, оскільки по відношенню до цих електронів заряд ядра екранується по-різному.
2. Принцип Паулі: в атомі не може бути і двох електронів з однаковими значеннями чотирьох квантових чисел. На орбіталі може знаходитися два електрони з різними спінами (ms = +½ і ms = –½).
Максимальне число електронів на підрівні визначають за формулою: К = 2 (2l + 1). Таким чином, маємо: s2, p6, d10, f14.
3. Правило Гунда (Хунда): у межах підрівня електрони розподіляються так, щоб сумарне спінове квантове число мало максимальне значення (спочатку по одному електрону на орбіталь, а потім по другому електрону).
| ↑ | ↑ | ↑ | Правильний розподіл р-електронів. |
| ↑↓ | ↑ | Неправильний розподіл р-електронів. |
У залежності від того, який підрівень заповнюється останніми електронами, розрізняють s-, p-, d-, f-елементи: s – елементи, в атомах яких останні електрони займають s-підрівень зовнішнього квантового рівня (Na, Mg, K); р – елементи, в атомах яких останні електрони займають р-підрівень зовнішнього квантового рівня (C, О, Cl, S); d – елементи, в атомах яких останні електрони займають d-підрівень (Тi, Cr, Fe, Cu); f-елементи, в атомах яких останні електрони займають f-підрівень другого від позаквантового рівня (Pr, Er, Eu).
Взаємозв’язок між квантовими числами, розрахунки числа підрівнів на енергетичних рівнях, числа атомних орбіталей (АО) на підрівнях і рівнях наведено в додатку 2.
Розділ 1.4. Періодичний закон i періодична система елементів
Д. I. Менделєєва
У 1869 p. Д. I. Менделєєвим відкрито і сформульовано періодичний закон: „Властивості простих тіл, а також форми і властивості сполук елементів перебувають у періодичній залежності від величини атомних ваг (мас) елементів”.
Теорія будови атома довела, що кількісною характеристикою, яка визначає хімічну природу елемента, є не маса атома, а його порядковий номер, який відповідає величині позитивного заряду ядра атома. Тому сучасне формулювання періодичного закону таке: властивості хімічних елементів, а також форми і властивості їхніх сполук перебувають у періодичній залежності від величини зарядів ядер їх атомів.
Графічним зображенням періодичного закону є періодична система елементів, яка складається з періодів, рядів і груп. Кожний елемент має свій номер, який називається порядковим або атомним.
Період – це горизонтальний ряд, у якому елементи розміщені в порядку зростання їхніх атомних мас (порядкового номера). Усього є сім періодів. I, II, III називаються малими, a IV, V, VI і VII – великими періодами, причому останній VII – незавершений. Усі періоди, за виключенням першого, який містить тільки два елементи, починаються лужним металом і закінчуються інертним газом. Періоди II і III одержали назву типових, оскільки властивості елементів у цих періодах закономірно змінюються від типового металу до інертного газу. У великих періодах цей перехід відбувається повільно.
Кожний малий період складається з одного ряду, а кожний великий період має два ряди – парний (верхній) і непарний (нижній). В елементів парних рядів великих періодів (з 4 по 10) переважають металічні властивості, але зміна властивостей зліва направо сповільнена. Для елементів непарних рядів (з 5 по 9) зміна властивостей відбувається аналогічно типовим періодам від активного металу до інертного газу, тобто прискорено. Особливістю VI і VII періодів є наявність родин елементів із близькими хімічними властивостями: родин лантаноїдів та актиноїдів.
Група – це вертикальний ряд, у якому розміщені елементи, які подібні за властивостями. Загальна кількість груп – 8. Кожна група поділяється на головну й побічну підгрупи. Номер групи відповідає вищому позитивному ступеню окиснення елементів, що входять до складу цієї групи. Виключення складають: F (VII група), ступінь окислення якого тільки –1; O (VI група), ступінь окиснення +2, –1, –2; Cu, Ag і Au (I група), виявляють ступінь окиснення від +1 до +3.
Періодичність зміни
 2017-12-16
2017-12-16 604
604








