В общем случае жидкости могут быть диэлектриками, проводниками и полупроводниками. Дистиллированная вода, например, - диэлектрик, а небольшое количество соли, добавленное в дистиллированную воду, делает её проводником электрического поля – электролитом.
Электролитами называются растворы и расплавы солей, оснований и кислот, являющиеся проводниками электрического тока. Заряженные частицы, обеспечивающие существование электрического тока в электролитах, образуются в результате электролитической диссоциации – распада молекул растворяемого вещества на ионы под действием молекул растворителя. Например, растворение медного купороса в воде:
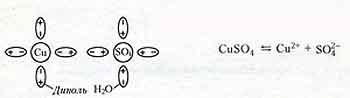
При отсутствии внешнего электрического поля ионы вместе с нераспавшимися молекулами находятся в тепловом хаотическом движении. Ионы противоположного знака при встрече могут образовать нейтральную молекулу (рекомбинация ионов – обратный процесс диссоциации).
Степень диссоциации –доля молекул, распавшихся на ионы. Она возрастает с увеличением температуры и зависит от концентрации раствора и от электрических свойств растворителя.
 При помещении в электролит двух электродов, присоединённых к различным полюсам источника тока, на хаотическое движение ионов накладывается их упорядоченное движение к соответствующим электродам: положительных ионов к катоду, отрицательных ионов – к аноду и в электролите возникает электрических ток, представляющий собой два потока ионов разных знаков в противоположных направлениях. Таким образом, характер проводимости электролитов – ионный.
При помещении в электролит двух электродов, присоединённых к различным полюсам источника тока, на хаотическое движение ионов накладывается их упорядоченное движение к соответствующим электродам: положительных ионов к катоду, отрицательных ионов – к аноду и в электролите возникает электрических ток, представляющий собой два потока ионов разных знаков в противоположных направлениях. Таким образом, характер проводимости электролитов – ионный.
Температурная зависимость сопротивления электролита объясняется в основном изменением удельного сопротивления:

где альфа - температурный коэффициент сопротивления.Для электролитов всегда  .
.
Поэтому
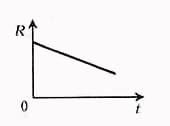
Сопротивление электролита можно рассчитать по формуле:

Законы электролиза.
При прохождении электрического тока через электролит происходит выделение на электродах составных частей электролита. Это явление называется электролизом.
Законы электролиза были установлены экспериментально Фарадеем в 1836г.
Их два.
Первый закон электролиза: количество выделившегося на электроде вещества пропорционально заряду, прошедшему через электролит:
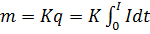 ,
,
где  масса выделившегося вещества,
масса выделившегося вещества,  коэффициент, зависящий от природы вещества и называемый электрохимическим эквивалентом.
коэффициент, зависящий от природы вещества и называемый электрохимическим эквивалентом.
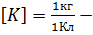 электрохимический эквивалент численно равен массе вещества, выделившегося на электроде при пропускании через электролит заряда равному
электрохимический эквивалент численно равен массе вещества, выделившегося на электроде при пропускании через электролит заряда равному 
Второй закон электролиза: электрохимические эквиваленты всех веществ пропорциональны их химическим эквивалентам:
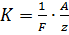 ,
,
где 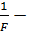 называют числом Фарадея,
называют числом Фарадея, 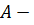 атомный вес,
атомный вес,  валентность данного вещества.
валентность данного вещества.
Опытным путём было установлено, что 
 2017-12-16
2017-12-16 1642
1642