Напівпровідники
Напівпровідниковими властивостями можуть володіти як неорганічні так і органічні речовини, кристалічні і аморфні, тверді і рідкі, немагнітні і магнітні. Їхможнакласифікувати за різнимиознаками:
за хімічним складом;
за кристалічною структурою;
за величиною ширинизабороненоїзони;
за практичнимзастосуванням.
Наведемо одну ізможливих схем класифікаціїнапівпровідників.
Неорганічні і органічні напівпровідники. Середорганічнихнапівпровідниківможнаназвати: атрацен С14Н10, нафталів С10Н8, фталоціаніни, пірен та багатоінших. Вониволодіють широким спектром властивостей і перспектив застосування. В даномукурсі ми не будеморозглядатигрупуорганічнихматеріалів.
Неорганічнінапівпровідникиподіляють на двігрупи: кристалічні та аморфні. За реакцією на магнітне поле кристалічнінапівпровідникиможнаподілити на слабомагнітні і магнітні. Магнітнінапівпровідники – цесполукиперехідних і рідкісноземельнихелементів з магнітнимпорядкомВостанній час виділяють в окремугрупу так званірозбавленімагнітніабо напівмагнітні напівпровідники. Цематеріали, якімістятьдомішкиабокомпоненти, атомиякихволодіютьнескомпенсованимимагнітними моментами (наприклад, CdTe:Fe, CdMnTe, HgMnTe та інші). Основу сучасноїелектронноїтехнікискладаютьнеорганічнікристалічнінапівпровідники. Їхможнаподілити на 3 групи:
елементарнінапівпровідники;
напівпровідниковісполуки;
напівпровідниковітвердірозчини.
Напівпровідниковимивластивостямиволодіють 12 хімічнихелементівперіодичноїсистемиД.І.Менделєєва (таблиця 1).
Таблиця 1. Елементарнінапівпровідники
| Період | ІІІ група | IVгрупа | Vгрупа | VIгрупа | VIІ група | |||||
| Елемент | Еg, еВ | Елемент | Еg, еВ | Елемент | Еg, еВ | Елемент | Еg, еВ | Елемент | Еg, еВ | |
| B | 1,11 | C* | 5,6 | |||||||
| Si | 1,12 | P | 1,5 | S | 2,5 | |||||
| Ge | 0,665 | As | 1,2 | Se | 1,8 | |||||
| α-Sn | 0,08 | Sb | 0,12 | Te | 0,36 | J | 1,25 |
Примітка: Вуглець С існує у двохалотропних формах – алмаз і графіт. Графіт за електричнимивластивостямиблизький до провідників (Еg< 0,1 Ев), а чистіалмази є діелектриками, Однак, штучніалмази за рахуноквведенихдомішокнабуваютьвластивостейнапівпровідників. Олово Sn при нормальнихумовах є добримпровідником, але при температурінижчій 13,2 °С переходить в α-модифікацію (сіре олово), яке проявляєнапівпровідниковівластивості. Однак, процесперетворення у твердійфазівідбуваєтьсядужеповільно, щоускладнюєотриманнякристалівпридатних для практичного застосування.
Як видно ізтаблиці 1, в системіданихелементіввиявлено ряд закономірностей у змініширинизабороненоїзони: вона зростає в кожномуперіоді при переходівіделементу до елементузліва направо, але зменшується в кожнійгрупі при русізверху вниз.По сукупностіелектрофізичнихвластивостей, відпрацьованостітехнологічнихпроцесів, кількості в номенклатуріприладів, яківипускаються, кремній і германійзаймаютьпровіднемісцесереднапівпровідниковихматеріалів.
Кремній, його очистка та утворення монокристалу
SiO2 + C → Si + 2CO.
СИЛІЦІЙ (Silicium< лат. silex, silicis — кремінь), Si — елемент IV А групи ІІІ періоду періодичної системи елементів Д.І. Менделєєва, порядковий номер. 14, атомеа маса 28,0855. Існує три стабільних ізотопи С.: 28Si (92,27%), 29Si (4,68%) та 30Si (3,05%). Штучно одержано радіоактивні ізотопи С
Залежно від умов одержання С. відрізняється за зовнішнім виглядом та властивостями. Аморфний С. одержують прожарюванням суміші С. діоксиду з магнієм. Це бурий реакційно здатний порошок. Якщо відновлювати SiО2 вугіллям в електропечах, утворюється кристалічний С. у вигляді сірих твердих, але досить крихких кристалів з Т плавлення 1415 °С. Аморфний і кристалічний С. не є алотропними модифікаціями С., вони різні лише за ступенем дисперсності. Аморфний С. значно легше вступає в хімічну взаємодію, ніж кристалічні компактні зразки. Дрібнодисперсний С. реагує із фтором за звичайних умов, хлором і киснем окислюється лише при підвищеній температурі з утворенням SiСl4 і SiО2. Взаємодія з вуглецем, азотом, бором відбувається лише при дуже високій температурі. Розчиняється С. лише в суміші фторидної та нітратної кислот з утворенням комплексної сполуки Н2[SiF6]. У розчинах лугів С. розчиняється навіть при зниженій температурі. Діоксид С. SiО2 — найбільш поширений оксид у земній корі. Він існує у вигляді декількох модифікацій. Звичайною формою SiО2 є кварц. Забруднений домішками кварц — звичайний пісок. У воді та кислотах, за винятком НF, SiО2 практично нерозчинний. Із лугами SiО2 реагує повільно, нагрівання прискорює цей процес з утворенням металосилікатів різної будови. Силікатні кислоти одержують дією мінеральних кислот на розчини метасилікатів. Висушений гель метасилікатної кислоти має пористу будову із дуже розвиненою внутрішньою поверхнею. Водневі сполуки С. називають силанами або силановоднями. Гідролізом галогенозаміщенихсиланів одержують гідроген-оксигенні сполуки кремнію — силікони.
Другий за поширенням на Землі після Оксигену, вміст у земній корі становить 27,6% маси. У вільному стані не трапляється. В організмі людини С. є практично у всіх тканинах. Кремній є непрямозонним напівпровідником з шириною забороненої зони 1,12 еВ. Електричного струму чистий кремній майже зовсім не проводить.
Монокристал (англ. monocrystal, нім. Einkristallm) — Монокристалічна або монокристалічна тверда речовина - це матеріал, в якому кристалічна решітка всього зразка є безперервною і непорушена до краю зразка без границь зерен. Відсутність дефектів, пов'язаних з межами зерен, може дати монокристалам унікальні властивості, зокрема механічні, оптичні та електричні, які також можуть бути анізотропними залежно від типу кристалографічної структури. Ці властивості, крім того, що роблять їх дорогоцінними в деяких дорогоцінних каменях, використовуються промислово в технологічних областях, особливо в області оптики та електроніки.Протилежним терміном є полікристал.
Полікристал — зразок із тією ж хімічною структурою, який складається із численних монокристалів — зерен, розділених границями.
Для вирощування монокристалу важливу роль відіграє його очистка, після якої вирощують кристал методами: Чохралського, Бріджемена, Зонної плавки або нанесеням тонких плівок.
----Очисткаочистка та утворення монокристалу
У вільномустані у природі не зустрічається.Найбільшрозповсюдженоюсполукоюкремнію є двоокискремнію SiO2, яка служить вихідноюсировиною для отриманнятехнічногокремнію. Процесвідновленнясировини, щомістить SiO2 у вигляді кварциту здійснюють в електропечах при температурібіля 2000 °С:
SiO2 + C → Si + 2CO.
Технічнийкремнійпредставляє собою дрібнодисперснийспечений порошок, щоміститьбіля 1 % домішок. Кремнійіз-за високоїтемпературиплавлення і реакційноїздатності по відношенню до любихконтейнернихматеріалівочистці не піддається; спробивикористатийого як напівпровідникнавіть в малочутливих до домішокприладах не дали успіху. Тому технічнийкремній служить лишесировиною для отриманнякремніюнапівпровідниковоїчистоти. Технологіяотриманнякремніюнапівпровідниковоїчистотиохоплюєнаступніоперації:
1. Перетвореннятехнічногокремнію у легколеткісполуки, зручні для очистки і якіпісляочищенняможуть легко відновитися. Такими сполуками є:моносилан SiH4, тетрахлоридкремнію SiCl4, трихлорсилан SiHCl3. Наприклад, для утвореннятрихлорсиланвикористовуютьреакціюхлорування сухим хлористимводнем при температурі 300-400 °С:
Si + 3HCl → SiHCl3 + H2.
Трихлорсиланпредставляє собою рідину з температурою кипіння 32°С. Тому він легко
очищується методами екстракції, адсорбції і ректифікації.
2. Очистка сполукфізичними і хімічними методами.
3. Відновленнясполук з виділенням чистого кремнію. Наприклад, відновлення SiHCl3
відбувається при 1373 К за реакцією:
SiHCl3 + H2 → Si +3HCl.
4. Кристалізаційна очистка і вирощування.
На відміну від германію, кремній очищують від домішок, в основному, хімічним методом. Кристалізаційні методи мають мету перетворити полікристалічний кремній в монокристали з певними властивостями.
В напівпровідниковому приладобудуванні використовують монокристалічний, полікристалічний, аморфний, епітаксійний (в планарній технології інтегральних схем), а в останні роки інтенсивно досліджується і пористий кремній.
Об’ємні монокристали кремнію вирощують методами витягування із розплаву (діаметром 100-150 мм) і безтигельною зонною плавкою. В процесі вирощування кремнію здійснюють його легування домішками ІІІ групи (в основному бором) і V групи (в основному фосфором), оскільки ці домішки утворюють у забороненій зоні кремнію мілкі домішкові рівні, які в області температур роботи приладів на його основі є іонізованими. Методом витягування із розплаву в промислових умовах отримують без дислокаційні монокристали кремнію діаметром до 150 мм і довжиною до одного метра з широким номіналом питомого опору. Вертикальна зонна безтигельна плавка дає змогу здійснювати кристалізаційну очистку кремнію від домішок, отримувати монокристали з малим вмістом кисню і великим часом життя неосновних носіїв заряду (до декілька тисяч мікросекунд).
Метод Бріджмена
Метод Бріджмена, або Метод Бріджмена-Штокбарґера — названий на честь фізика Персі Вільямса Бріджмена і використовується для вирощування великих монокристалів, таких як кремнію чи арсеніду галію.
Для процесу використовують горизонтально розділену піч. Температура у верхній частині печі є вище температури плавлення компонентів, а у нижній частині печі вона є нижчою. Через опускання тигля який обертається, розплав кристалізується при переході в нижчу частину пічки.
Особливою частиною цього методу є також тигель. Він є вужчим у нижній частині, там де спочатку починається кристалізація. Нижче звуження тигля кристалізується розплав спочатку полікристалічно, однак при проходженні звуження росте лише один окремий монокристал в решті розплаву, який служить одночасно центром кристалізації. Отже решта розплаву при затвердінні(кристалізації) повністю приймає орієнтацію зародка утворюючи єдиний монокристал. 
Метод Чохральського
Метод Чохральського — технологія вирощування монокристалів з тигля витягуванням із розплаву при повільному обертанні. Цей метод був запропонований у 1918 році польським вченим Яном Чохральським. Метод Чохральського набув неабиякого поширення завдяки простоті реалізації та задовільній якості монокристалів. Найбільшого поширення набуло вирощування кремнію як найдоступнішого матеріалу для напівпровідникової промисловості. Монокристали кремнію, вирощені даним методом знаходять застосування у двох сферах: сонячній енергетиці та виробництві напівпровідникових приладів.
Метод Чохральського є методом напрямленої кристалізації. Суть методу полягає у тому, що у розплав напівпровідникового матеріалу занурюють зародковий монокристал — затравку. Сплавляють, а по досягненні певної температури переохолодження розплаву, необхідної для початку кристалізації на міжфазній границі затравка — розплав, починають відносно повільно витягувати монокристал. При цьому відведення прихованої теплоти кристалізації, — енергії, яка звільняється при утворенні впорядкованих атомних зв'язків кристалічної структури — здійснюється через вирощену частину монокристала. Регулювання діаметра монокристала здійснюється, головним чином, зміною швидкості витягування монокристала і, меншою мірою, зміною температури розплаву. Регулювання умов вирощування відбувається за принципом ПІД-регулятора. Для задоволення умов осьової симетрії теплових полів монокристала, розплаву та теплового вузла печі застосовують обертання монокристала та (або) тигля з розплавом навколо вертикальної осі.
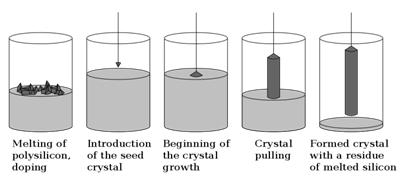
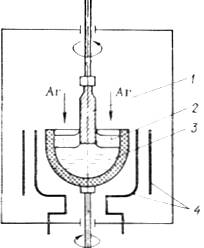
Рис.2. Схема вирощуваннямонокристалівсполук з леткими компонентами методом витягуванняіз-під шару інертного флюсу: 1 – кристал, якийвитягують; 2 – герметизуючий шар інертного флюсу; 3 – тигель з розплавом; 4 – нагрівник з екраном.
Метод зонної плавки
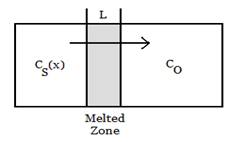
Плавна зона (або процес переробки зон або плаваючою зони або зони плавної переміщення) - група аналогічних способів очищення кристалів, в якій розсмоктується вузька область кристала, і ця розплавлена зона рухається вздовж кристалу. Розплавлена область розсмоктує нечисту тверду речовину на її передній кромці і залишає після порожнього матеріалу, закріпленого за ним, коли воно проходить через злиток. Домішки концентруються в розплаві і переміщуються до одного кінця злитку. Переробка зони була винайдена Джоном ДесмондБернаромі надалі розроблена Вільям ГарднеромПфаном в BellLabs як метод підготовки матеріалів високої чистоти.
Принцип полягає в тому, що коефіцієнт сегрегації k (співвідношення домішки в твердій фазі і в рідкій фазі) зазвичай менше, ніж один. Тому на границі твердого тіла / рідини атоми домішки будуть дифундувати до рідкої області. Таким чином, пропускаючи кристалічний бульб через тонкий розділ печі дуже повільно, такий, що лише в невеликій частині бульб розливати в будь-який час, домішки будуть розділені на кінці кристала. Через відсутність домішок у залишкових областях, які затвердіють, бульб може зростати як ідеальний монокристал, якщо селекційний кристал розміщений на підставі для ініціювання обраного напрямку росту кристалів. Коли потрібна висока чистота, наприклад, у напівпровідниковій промисловості, нечистий кінець бульб відрізається, і повторюється процес очищення.
У зоні переробки розчинні речовини відокремлюються на одному кінці злитку, щоб очистити залишок або концентрувати домішки. У вирівнюванні зони мета полягає в тому, щоб розподілити розчин рівномірно по всій очищеному матеріалу, який можна шукати у вигляді монокристалу.
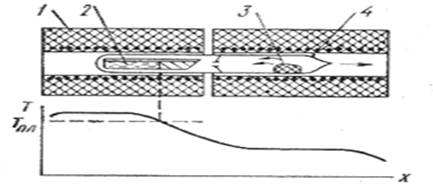
Рис.1. Схема двотемпературного синтезу сполук з леткими компонентами: 1 – нагрівний блок; 2 – контейнер з розплавом; 3- конденсат леткого компонента; 4 – кварцова ампула
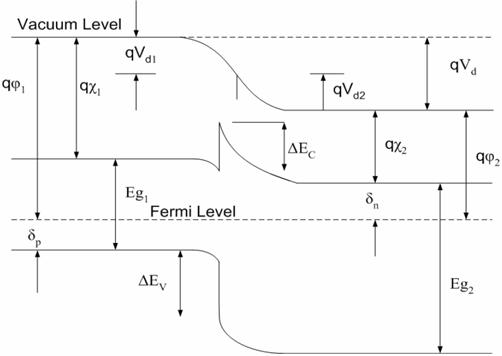
Гетероперехід
Гетероперехід собою представляє процес, що відбувається між двома шарами або областями несхожих кристалічних напівпровідників. Ці напівпровідникові матеріали мають нерівні властивості, на відмінно від гомопереходів. Найчастіше вигідно розробляти електронні зони енергії у багатьох твердо тільних матеріалах, включаючи напівпровідникові лазери, сонячні елементи та транзистори ("гетеро-транзистори). Вимога про те, щоб кожен матеріал був напівпровідником з нерівними забороненими зонами, є дещо вільним, особливо в малих масштабах, де електронні властивості залежать від просторових властивостей.
Рис
Більш сучасним визначенням гетеропереходу є інтерфейс між будь-якими двома твердо тільними матеріалами, включаючи кристалічні та аморфні структури металевого, ізоляційного, швидкого іонного провідника та напівпровідникових матеріалів.У 2000 році Нобелівська премія з фізики була присуджена спільно ГербертуКремеру (Каліфорнійський університет, Санта-Барбара, Каліфорнія, США) та Жоресу Івановичу Алферову (Інститут ім. Іоффе, Санкт-Петербург, Росія) за "розробку напівпровідникових гетероструктур, що використовуються на швидкісних - та оптоелектроніка ".
З’єднання елементів.
Напруга, струм, опір, провідність, індуктивність, ємність, батарей.
На практиці часто буває необхідно отримати більшу напругу або струм, ніж може дати один елемент живлення (акумулятор). Для цього вдаються до поєднання елементів у батареї. Існують три способу з’єднання елементів: послідовне, паралельне та змішане.
Послідовне з’єднання називають струмовим, всі компоненти в ньому з'єднуванні мають однаковий струм. Основна характеристика схеми полягає в тому, що вона має лише один шлях, у якому може протікати його струм. Відкриття або розрив послідовної схеми в будь-якій точці призводить до того, що ціла ланцюг "відкривається" або припиняється працювати.
Для струму:
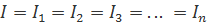
Для напруг:
Повна напруга в колі при послідовному з'єднанні, або напруга на полюсах джерела струму, дорівнює сумі напруг на окремих ділянках кола:
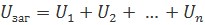
Аналогічним є для Індуктивностей
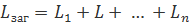
Для опорів:
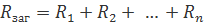
Для опорів (можна за провідностями):

Аналогічним є дляКонденсаторів
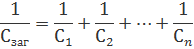
Для окремих випадків двох резисторів послідовно повна провідність дорівнює
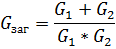
При Паралельному з’єднані величини ведуть себе навпакипари Струм та Напруга; Опір та Провідність.
Напруга: 
Струм: 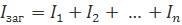
Схоже з Ємностями
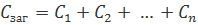 Є наслідком з правил кірхгофа
Є наслідком з правил кірхгофа

Опір визначається як: обернена сума від суми обернених опорів
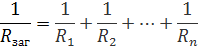
Схоже з індуктивностями:
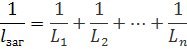
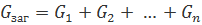
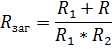
Деякі висновки при проектуванні схем
Загальний опірзавжди буде менше, ніжзначеннянайменшого опору:
Акумулятор - це сукупність елементів. Якщо їх з'єднати послідовно, напруга акумулятора буде сумою напруг елементів.
Якщо комірки акумулятора підключені паралельно, напруга акумулятора буде такою ж, як і напруга, але струм, що подається кожною осередок, буде часткою від загального струму
Деякі сонячні електричні системи мають батареї паралельно для збільшення обсягу зберігання; близьке наближення загальної кількості ампер-годин - це сума всіх батарей паралельно.
Загальним застосуванням Послідовної схеми у побутовій електроніці в батареї, де для одержання зручної робочої напруги використовують кілька стільникових з'єднань.
Кислотно-свинцеві акумулятори (Lead–acidbattery)
Свинцово-кислотний акумулятор був винайдений у 1859 році французьким фізиком ГастономПлане,У 1878 році КаміллФор удосконалив його конструкцію, покривши пластини акумулятора свинцевим суриком. Є один з найпоширеніших акумуляторів. Незважаючи на дуже низьке співвідношення енергії до маси та низький ККД, має здатність забезпечувати високі струми, елементні комірки мають відносно велике відношення потужності до ваги. Ці особливості, поряд з їх низькою вартістю, роблять їх привабливими для використання в автотранспортних засобах, щоб забезпечити високий струм, необхідний автомобільним стартерними двигунам.Оскільки вони недорогі порівняно з новими технологіями, свинцево-кислотні акумулятори широко застосовуються навіть тоді, коли струм напруги не є важливим, а інші конструкції можуть забезпечувати більшу щільність енергії. Широкоформатні свинцево-кислотні конструкції широко застосовуються для зберігання в резервних блоках живлення в вежах стільникових телефонів, високодоступних параметрах, автономні енергосистеми. Для цих ролей модифіковані версії стандартної осередки можуть бути використані для поліпшення часу зберігання та зменшення вимог до технічного обслуговування. Гель-комірки та поглинені батарейки із склопакетами є загальними в цих ролях, спільно відомих як VRLA (регульовані свинцем кислоти) батареї.
Принцип дії; розряджання-заряджання:
Під час розряду 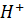
Вироблений на негативних пластинах, переміщується в розчин електроліту, а потім споживається в позитивні пластини,
тоді як 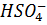 споживається на обох пластинах. Зворотне відбувається під час заряджання. Цей рух може бути електричним приводом протонного потоку або механізму Гроттуса, або дифузії через середовище, або потоком рідкого електролітного середовища. Оскільки густина більша, коли концентрація сірчаної кислоти вища, рідина, як правило, циркулює по конвекції. Тому оболонка з рідким середовищем має тенденцію швидко розряджатися та швидко зарядитися більш ефективно, ніж інша аналогічна система.
споживається на обох пластинах. Зворотне відбувається під час заряджання. Цей рух може бути електричним приводом протонного потоку або механізму Гроттуса, або дифузії через середовище, або потоком рідкого електролітного середовища. Оскільки густина більша, коли концентрація сірчаної кислоти вища, рідина, як правило, циркулює по конвекції. Тому оболонка з рідким середовищем має тенденцію швидко розряджатися та швидко зарядитися більш ефективно, ніж інша аналогічна система.
 (розряд)
(розряд)
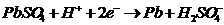 (заряд)
(заряд)
На позитивному Електроді:
 (Розряд)
(Розряд)
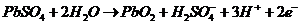 (заряд)
(заряд)
Сумарна реакція в свинцевому акумуляторі має місце:
 (розряд)
(розряд)
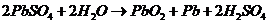 (заряд)
(заряд)

Рис.
Для заряду свинцево-кислотного акумулятора його пластини відповідно до полярності підключають до зарядного пристрою — виникає зворотна хімічна реакція. В результаті цього з електроліту поглинається вода, збільшуючи концентрацію кислоти, на негативній пластині виділяється металевий свинець, а на позитивній — його двоокис.
Глибокий розряд або постійні часткові розряди свинцево-кислотних акумуляторів неприпустимі, тому що при цьому виникає сульфатація пластин, вона обширна, на їх поверхні виникають білі кристали сірчанокислого свинцю, які не розчинні в електроліті сірчаної кислоти.
Сульфатація також виникає при недостатньому рівні розчину кислоти, коли пластини лише частково заповнені електролітом і ін.
Глибока сульфатація призводить до підвищеного виділення газу в акумуляторі, через що він може, за відсутності захисного пристрою, вибухнути.Слід зазначити, що неглибока сульфатація завжди супроводжує функціонування працездатного акумулятора, в той час як глибока сульфатація може призвести до повного виходу пристрою з ладу.
Переваги та недоліки:
До переваг свинцево-кислотних акумуляторів відносяться: довговічність, невелика вартість, надійність, низький внутрішній опір і відсутність ефекту "пам'яті"
До недоліків: велика маса; використання отруйних речовин; неможливість розряду акумулятора при температурі нижче -40°С і заряду при 0°С; неможливість зберігання пристрою в розрядженому стані; в окремих випадках — виділення газів при неправильній експлуатації; значний саморозряд, що досягає 1% протягом 24 годин.
Акумуляторні свинцево-кислотні батареї із зарядом в 1 А·год/батарея забезпечують силу струму набагато меншу, ніж у лужних. Свинцево-кислотні акумулятори мають вищу робочу напругу в порівнянні з лужними акумуляторами.[1] Але вони мають нижчі питомі енергетичні характеристики і значно менший ресурс при циклічності до вичерпання запасеної ємності. Ці батареї частіше використовуються для роботи в буферному режимі, при якому вони зберігають працездатність до 10–12 років.
Великий досвід їх застосування в системах безперебійного живлення, телекомунікації, охоронних і сигнальних, а також постійне вдосконалювання самих джерел струму дозволяють розраховувати на стабільність сфери їх використання в найближчі роки.
Перший літій-іонний акумулятор вивела на ринок корпорація Sony в 1991 році.
Спроби розробити літієві електричні батареї, що перезаряджаються, проводилися в 70-х р. ХХ ст., але були невдалими через неможливість забезпечення потрібного рівня безпеки при їх експлуатації оскільки літій занадто активний і настільки бурхливо реагує з водою, що може спалахнути. Було встановлено, що в ході циклів заряду-розряду електричної батареї з металевим літієвим електродом може виникнути коротке замикання всередині акумуляторної батареї.При цьому температура всередині акумулятора може досягти температури плавлення літію. У результаті бурхливої хімічної взаємодії літію з електролітом відбувається вибух.
Літій-іонний акумулятор (англ. Lithium-ion battery, скорочено Li-ion) — один з двох основних типів літієвих електричних акумуляторів з категорії вторинних електричних батарей, який різниться з літій-полімерним акумулятором лише типом електроліту, що використовується при їх виготовленні. Широко розповсюджений в побутовій електроніці.
Назву літій-іонні акумулятори одержали через те, що електричний струм в зовнішньому колі з'являється через перенос літієвих іонів від анода до катода на основі різних сполук.
Хімічний склад, експлуатаційні характеристики, вартість та безпечність акумуляторів відрізняються залежно від типу літій-іонних акумуляторів. Найбільш поширеним у переносній електроніці є акумулятори з катодом на оксиді кобальта (LiCoO2) що мають високу енергетичну густину, але мають недолік з точки зору безпеки експлуатації, особливо при пошкодженні. Літій-ферум-фосфатні (відомі як літій-залізо-фосфатні, LiFePO4), літій-манган-оксидні (LiMn2O4, Li2MnO3 або літій-манганові акумулятори LMO) та літій-нікель-манган-кобальт-оксидні (LiNiMnCoO2 чи NMC) акумулятори, що теж названі за типом катоду, пропонують нижчі рівні енергетичної густини, але мають довший життєвий цикл та безпечніші з хімічної точки зору. Такі акумулятори широко застосовуються в електроінструментах, медичному обладнанні та ін. NMC, зокрема, є лідером за використанням у автомобільній промисловості. Нові літій-сульфурні акумулятори обіцяють найвище відношення експлуатаційних характеристик до ваги.
Подібна кваліфікація за назвами є не науковою, а радше маркетинговою, оскільки проводяться роботи з розробки акумуляторів з катодом LiFePO4 та анодом Li4Ti4O12, що у цій системи не матиме простої назви.
Число циклів заряд/розряд до втрати 20% міскості: 500–1000
Час швидкого заряду: 2-4 години
Допустимий перезаряд: дуженизький
Саморозряд при кімнатнійтемпературі: 7% в рік
Струм навантаженнявідносноміскості (С):
— піковий: понад 2С
— найбільшедопустимий: до 1С
Діапазонробочих температур: −20 — +60 °C
Сучаснімалогабаритніакумуляторипрацездатні при струмах розряду до 2С, потужні — до 10-20С. Діапазонробочих температур: від −20 до +60оС. Але багатовиробниківвжерозробилиакумулятори, працездатні при −40 °С. Можливерозширеннятемпературногодіапазону і в біквищих температур.
В основному Li-ion акумулятори краще всього функціонують при кімнатній температурі. Робота при підвищеній температурі скорочує термін дії їх використання. Підвищена температура тимчасово протидіє внутрішньому опору акумулятора, збільшення якого призводить до його зносу. Саморозряд становить 4-6% за першии місяць, потім — значно менше: за 12 місяців акумулятори втрачають 10-20% запасеної ємності.
Ресурс — 500–1000 циклів. Всі літієві акумулятори мають досить прийнятні для зберігання параметри. Втрата ємності за рахунок саморозряду 5-10% за рік.Наведені показники варто розглядати як деякі номінальні орієнтири. Для кожного конкретного акумулятора, наприклад, розрядна напруга залежить від струму розряду, рівня розрядженості, температури; ресурс залежить від режимів (струмів) розряду й заряду, температури, глибини розряду; діапазон робочих температур — від рівня виробленого ресурсу та припустимих робочих напруг.До недоліків Li-ion акумуляторів варто віднести чутливість до перезарядження і сильного розряду, через це вони повинні мати обмежувачі заряду й розряду.
Принцип роботи батарей заснований на переміщенні позитивно зарядженихіонівлітіюLi+ міжпозитивними й негативнимиелектродами в процесірозрядки й зарядки. Металевийлітій уцихпроцесахучасті не бере, тому не виникає будь-яких проблем з відновленнямелектродів, щозабезпечуєстабільність і безпеку при використаннібатареї.
Наявність негативного електрода, якийприймає і віддаєіони, є загальним для всіх систем, але існує широкий вибірматеріалів, придатних для реалізації позитивного електрода й здатнихзабезпечуватирізницюпотенціалівміжелектродами до 3 В
Для нормальної роботи будь-якої електрохімічної батареї необхідно як мінімум три компоненти: два електроди й електроліт, що забезпечує перенос іонів. У малогабаритних батареях електроліт може бути твердим, рідким і желеподібним. Рідкі електроліти застосовуються, як правило, у клеєних циліндричних батареях, але через високу небезпеку займання вони не знайшли застосування в інших системах. Для розробки твердих електролітів для літієвих батарей, що мають можливість перезаряджання, пішло два десятиліття напружених досліджень. На їх основі стало можливим створення тонких і пласких батарей, але з невеликим діапазоном робочих температур та малою потужністю.
Розрахунок сонячної батареї
 2018-01-08
2018-01-08 486
486






