Раздел 2 Основы теории химической коррозии
Определение химической коррозии. Условия возможности протекания процесса. Основные стадии. Условие сплошности пленок. Законы роста пленок во времени в зависимости от их толщины и характера контроля процесса. Состав пленок. Изменение закона роста во времени.
Химическая коррозия металлов является самопроизвольным их разрушением вследствие химического взаимодействия с внешней средой. Характерными особенностями химической коррозии являются протекание процессов окисления металлов и восстановления окислителя в одном акте, отсутствие возникновения электрического тока и образование продуктов коррозии непосредственно в зоне реакции взаимодействия металла с внешней средой.
Химическая коррозия является гетерогенной реакцией взаимодействия жидкой или газовой фазы с металлами и делится на 2 вида:
- газовая коррозия;
- коррозия в жидких неэлектролитах.
Газовая коррозия
В нефтеперерабатывающей промышленности газовой коррозии подвергаются трубы печей при воздействии продуктов горения топлива, реактор, реакционные колонны и другая аппаратура под воздействием водорода, сероводорода, окиси углерода, азота, кислорода и других газов при высоких температурах. Обычно термин «газовая коррозия» относят к разрушению металлов, вызываемому действием паров и газов при высоких температурах, хотя по существу его можно применять и к более низким температурам при условии, что на металле не конденсируется пленка жидкости, проводящая электрический ток.
Наибольшее значение в практических условиях имеет газовая коррозия при повышенных температурах на границе металла с газовой фазой. Продуктами газовой коррозии обычно являются оксиды металлов, однако в зависимости от условий эксплуатации могут образовываться и другие соединения, например сернистые металлы.
Термодинамика газовой коррозии
Термодинамическая возможность протекания реакции коррозионного процесса определяется по величине изменения свободной энергии системы при протекании коррозионной реакции. В практических условиях, например в процессе газовой коррозии металлов при различных температурах, подобное суждение наиболее просто и удобно может быть сделано на основании сопоставления упругости диссоциации получаемого продукта реакции окисления и парциального давления кислорода в газовой фазе.
Так, химическая реакция окисления
Ме + ½ О2 ↔ МеО
будет находиться в равновесии, если парциальное давление кислорода ( ) и упругость диссоциации окисла (
) и упругость диссоциации окисла ( ) станут равны. При
) станут равны. При  >
>  реакция будет протекать в сторону образования оксида. Наоборот, при
реакция будет протекать в сторону образования оксида. Наоборот, при  >
>  реакция будет протекать в обратном направлении, т.е. оксид будет диссоциировать на чистый металл и кислород. Известно, что упругость диссоциации оксидов с повышением температуры возрастает у всех металлов. Поэтому, начиная от какой-то температуры и выше, когда упругость диссоциации оксида металла становится больше парциального давления кислорода в воздухе (при атмосферном давлении
реакция будет протекать в обратном направлении, т.е. оксид будет диссоциировать на чистый металл и кислород. Известно, что упругость диссоциации оксидов с повышением температуры возрастает у всех металлов. Поэтому, начиная от какой-то температуры и выше, когда упругость диссоциации оксида металла становится больше парциального давления кислорода в воздухе (при атмосферном давлении  = 0,21 ат), металл перестает окисляться и становится вполне благородным по отношению к кислороду. Так, например, серебро при температуре 300К термодинамически еще не устойчиво, а при 400К и при всех более высоких температурах упругость диссоциации Ag2O превышает парциальное давление кислорода в воздухе. При температуре 2000К медь тоже становится неокисляемым металлом, однако для таких металлов, как Fе, Zn, Ni и др., даже при этих температурах упругость диссоциации окислов остается еще достаточно низкой и, следовательно, протекание реакции окисления вероятно.
= 0,21 ат), металл перестает окисляться и становится вполне благородным по отношению к кислороду. Так, например, серебро при температуре 300К термодинамически еще не устойчиво, а при 400К и при всех более высоких температурах упругость диссоциации Ag2O превышает парциальное давление кислорода в воздухе. При температуре 2000К медь тоже становится неокисляемым металлом, однако для таких металлов, как Fе, Zn, Ni и др., даже при этих температурах упругость диссоциации окислов остается еще достаточно низкой и, следовательно, протекание реакции окисления вероятно.
Необходимо учесть, что температурная зависимость для кинетики процесса окисления совершенно иная, чем для термодинамической вероятности окисления. Поэтому нет никакого противоречия в том, что степень термодинамической вероятности окисления металла с повышением температуры падает, а реальная скорость окисления (при условии, что термодинамически этот процесс остается еще возможным) с повышением температуры возрастает.
Пленки на металлах
В большинстве случаев продукты газовой коррозии образуются и остаются на металле в виде пленки. Пленки продуктов коррозии определяют кинетику процесса и в случае наличия защитных свойств могут привести к замедлению коррозионного процесса. Чтобы пленка продуктов коррозии обладала защитными свойствами, она должна быть сплошной, не разрушаться в агрессивной среде, прочно сцепляться с основным металлом и обладать близким к нему коэффициентом теплового расширения. Если пленка пористая, рыхлая и характеризуется плохим сцеплением с основным металлом, то даже при условии инертности в данной агрессивной среде, она не будет обладать защитными свойствами.
Пленки по толщине делятся на три группы:
- тонкие (невидимые), δ < 4000 нм;
- средние (дающие цвета побежалости), δ = от 4000 до 50000 нм;
- толстые (видимые), δ > 50000 нм.
Толщина пленок, образовавшихся при взаимодействии металла с сухим воздухом, различна и зависит от рода металла, температуры и других факторов. Толщина пленок на меде и железе при комнатной температуре составляет 100 – 300 нм, а на алюминии 1000– 1500 нм. При повышении температуры толщина пленки увеличивается и дает цвета побежалости. Так, при нагреве железа до 4000C в течение 1 ч на нем образуется желтая пленка толщиной 4600 нм, через 2 ч – красная пленка толщиной 5800 нм, а через 3 ч – синяя пленка толщиной 7200 нм. Примером толстой видимой пленки является окалина на железе или пленка, полученная на алюминии анодированием, имеющая толщину 10 – 15мкм, а в некоторых случаях – до 200 – 500 мкм. Наличие тонких, невидимых пленок было доказано различными способами:
- если сломать стальной образец (иглу, лезвие) под ртутью, то произойдет амальгамирование поверхности; если излом произвести на воздухе, а затем погрузить образец в ртуть, то амальгамирования не произойдет. Это объясняется образованием тончайшей окисной пленки, препятствующей амальгамированию;
- если железную полированную пластину нагреть с одного конца, то вследствие неравномерности толщины пленки, на поверхности пластины появятся цвета побежалости (желтый, красный, пурпурный, фиолетовый, синий).
При нанесении на различные участки поверхности железа капли азотно-кислой меди, можно определить защитные свойства пленки. В местах, где пленка не обладает защитными свойствами, протекает реакция
Fe + Cu(NO3)2 = Fe(NO3)2 + Cu,
и под каплей будет происходить выделение меди.
Наибольшими защитными свойствами пленка обладает не у нагретого конца, т.е. где пленка толще, а в преджелтой зоне, где пленка невидима;
Изоляция пленок от поверхности металла является самым наглядным доказательством их существования. Благодаря оптическим эффектам отражения света эти пленки, невидимые на поверхности металла, становятся видимыми. Если поместить металл в среду, которая хорошо растворяет металл, но не растворяет пленку, и нарушить целостность пленки, то металл растворяется, а пленка остается в изолированном виде.
Условия сплошности пленок
Защитными свойствами могут обладать только сплошные, т.е. покрывающие сплошным слоем всю поверхность металла, пленки. Условие сплошности определяется соотношением объемов образованного окисла и исходного металла.
Если объем продуктов коррозии Vок меньше, чем объем металла Vме, образующего это соединение, пленка будет пористой и обладает слабыми защитными свойствами. Наоборот, если объем продуктов коррозии больше, чем объем окислившегося металла, то можно ожидать образования сплошных пленок с повышенной способностью защищать от коррозии.
Соотношение объемов образованного оксида и исходного металла может быть легко подсчитано. Предположим, что окислится 1 грамм-атом металла. Его объем равен
 (9)
(9)
где А – атомная масса металла;
d – плотность металла.
Объем полученного оксида будет равен
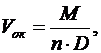 (10)
(10)
где М – молекулярная масса окcида;
D – плотность оксида;
n – число атомов металла в молекуле оксида.
Соотношение между объемом оксида и объемом металла
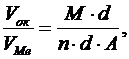 (11)
(11)
Щелочные и щелочноземельные металлы, указанное соотношение у которых меньше 1, образуют рыхлые пленки, со слабыми защитными свойствами и характеризуются высокими скоростями окисления. Металлы с соотношением  образуют, как правило, пленки, значительно тормозящие дальнейшее протекание процесса окисления, т.е. обладающие хорошими защитными свойствами. Однако при соотношении
образуют, как правило, пленки, значительно тормозящие дальнейшее протекание процесса окисления, т.е. обладающие хорошими защитными свойствами. Однако при соотношении 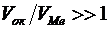 не следует ожидать высоких защитных свойств пленки. Ориентировочно
не следует ожидать высоких защитных свойств пленки. Ориентировочно  не должно быть более 2,5-3.
не должно быть более 2,5-3.
В табл. 2 приведены данные рассчитанного соотношения объемов  для ряда металлов.
для ряда металлов.
Эти данные подтверждают условия сплошности пленок. Так, натрий, кальций, барий, магний при окислении не могут образовать сплошных пленок, так как у этих металлов  . Молибден и вольфрам тоже не образуют сплошных пленок, так как у них
. Молибден и вольфрам тоже не образуют сплошных пленок, так как у них  .
.
Таблица 2
Отношение объемов оксида и металла для некоторых металлов
| Металл | Оксид |  |
| натрий кальций барий магний кадмий алюминий свинец цинк никель хром железо молибден вольфрам | Na2O CaO BaO MgO CdO Al2O3 PbO ZnO NiO Cr2O3 Fe2O3 MoO3 WO3 | 0,57 0,64 0,74 0,79 1,21 1,24 1,29 1,57 1,60 2,03 2,16 3,45 3,36 |
Механизм окисления металлов
Для большинства случаев окисления основным направлением диффузии является движение металла через пленку наружу и в меньшей степени - диффузия кислорода в обратном направлении.
Так как оксидные и солевые пленки на металлах имеют ионную кристаллическую структуру, обладающую, как правило, ионной и в некоторой степени электронной проводимостью, то можно ожидать диффузию через пленку не непосредственно атомов металла, а ионов металла и самостоятельно электронов. Можно также предполагать возможность диффузии ионов кислорода в противоположном направлении. Ионизация кислорода при этом происходит на внешней поверхности прошедшими через пленку электронами. Естественно, что допущение ионного характера диффузии не исключает возможности параллельного протекания и атомной диффузии.
Ион металла имеет меньший радиус, чем атом. Наоборот, анионы имеют больший радиус, чем атомы соответствующего металлоида. Следовательно, в общем случае можно предполагать, что от металла сквозь пленку двигаются ионы металла, а с поверхности пленки вглубь - атомы кислорода, ионизация которых происходит уже в самой пленке. Из-за большей подвижности при диффузии металлических ионов преимущественный рост пленки происходит вблизи ее внешней поверхности (рис.3).
|

Законы роста пленок
Исходя из современной теории роста пленок, образование и их дальнейший рост осуществляется взаимной двусторонней диффузией как окислительного реагента к поверхности металла, так и металла к внешней поверхности пленки.
Скорость роста защитной пленки находится в зависимости от диффузии и скорости химического превращения и определяется уравнением, предложенным Эвансом:
 (12)
(12)
где y – толщина пленки;
τ – время ее образования;
Кd – константа диффузии при данных условиях;
Кс – константа скорости химической реакции образования пленки;
Со – концентрация действующей среды на внешней поверхности пленки.
При достаточно толстой пленке величина y2/Kd значительно больше чем 2y/Kc. Принебрегая последней, получаем зависимость роста толщины пленки от процесса диффузии:

Заменяя величины 2КdCo через k1, получаем уравнение параболы
 (13)
(13)
В этом случае (при достаточно большой толщине пленки) скорость роста пленки контролируется диффузией.
На рис.4а приведено графическое изображение параболической зависимости для окисления железа на воздухе при различных температурах.
|

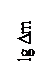

На рис. 4б показано преобразование парабол в прямые линии в логарифмических координатах, при котором
 ,
,
где Δm - увеличение массы, прямо пропорциональное толщине пленки у.
При малой толщине пленки влияние y2/Kd будет незначительным по сравнению с 2y/Kc и уравнение примет вид
у = КсСоτ.
Обозначая КсСоτ через k2, получаем линейное уравнение зависимости толщины пленки от времени
у = k2τ, (14)
При малой толщине пленки рост ее контролируется только скоростью химического превращения, т.е. коррозионный процесс подчиняется кинетическому контролю.
При смешанном диффузно-кинетическом контроле окисления металлов нельзя пренебречь ни одним из членов уравнения Эванса. Тогда путем приведения к общему знаменателю и умножения левой и правой части уравнения на С0 получим:

Подставляя вместо КсСo=k2 и вместо 2КdCo=k1, получим
k1у2 + k2у = k1k2τ (15)
Эта зависимость может быть преобразована в прямую линию построением графика τ/  m = f(
m = f( m), при этом k2 = ctg α; 1/k1 = τ
m), при этом k2 = ctg α; 1/k1 = τ  m при
m при  m = 0. График этой зависимости от окисления углеродистой стали на воздухе, насыщенном парами воды при 800оС, приведен на рис. 5а, а на рис. 5б показано преобразование зависимости в прямую линию.
m = 0. График этой зависимости от окисления углеродистой стали на воздухе, насыщенном парами воды при 800оС, приведен на рис. 5а, а на рис. 5б показано преобразование зависимости в прямую линию.
|




Рост оксидных пленок при диффузно-кинетическом контроле может быть также выражен степенным законом:
уn=knτ, (16)
где n - показатель степенного закона; причем 1 < n < 2, kn = const. Этот закон пригоден для описания кривой на рис. а, что подтверждается спрямлением ее в логарифмических координатах lg  m – lgτ, при котором
m – lgτ, при котором
n = ctg α;  при lg τ = 0.
при lg τ = 0.
Рост оксидной пленки по законам 15 и 16 имеет место, если соизмеримы скорости химической реакции окисления и диффузионных процессов в оксидной пленке.
Для ряда металлов установлена логарифмическая зависимость между толщиной пленки и продолжительностью ее роста:
у = ln (kτ) (17)
Логарифмический закон роста пленки установлен, например, для алюминия и цинка в интервалах температур от 25 до 225оС, железа – до 375оС, меди – до 100оС. При изображении логарифмической зависимости в полулогарифмических координатах у – lg τ получается линейная зависимость.
Кинетические кривые процесса окисления имеют большое практическое значение. Они позволяют без проведения длительных испытаний (полгода и более) оценить окалиностойкость металлов и сплавов путем сопоставления показателей и коэффициентов уравнений. Так, для нижеприведенных сталей было показано понижающее влияние добавки марганца на стойкость к высокотемпературному окислению:
Х18Н11С2ГА  m2,06 = 1,096τ,
m2,06 = 1,096τ,
Х18Н11С2Г2А  m1,32 = 0,596τ,
m1,32 = 0,596τ,
Х18Н11С2Г3А  m1,27 = 0,212τ.
m1,27 = 0,212τ.
 В процессе роста пленок может происходить их разрушение. Причинами, вызывающими разрушение пленок при их росте, являются недостаточная пластичность пленок, изменение кристаллической структуры при повышении температуры, изменение объема, различие в величине и характере напряжений вблизи внешней и внутренней поверхности пленок, а также образование в пленках трещин и отслаивание пленок.
В процессе роста пленок может происходить их разрушение. Причинами, вызывающими разрушение пленок при их росте, являются недостаточная пластичность пленок, изменение кристаллической структуры при повышении температуры, изменение объема, различие в величине и характере напряжений вблизи внешней и внутренней поверхности пленок, а также образование в пленках трещин и отслаивание пленок.
 | |||
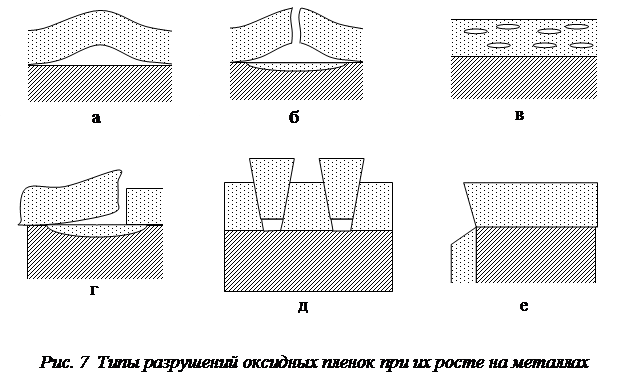 |
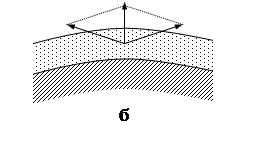
Так, внутренние сжимающие напряжения (рис.6,а), появляющиеся при росте толщины пленки, приводят к ее отслаиванию, если прочность пленки на разрыв велика, а ее адгезия к поверхности металла недостаточна (рис. 7,а). Внутренние напряжения сжатия на неровной поверхности (рис. 6,б) способствуют образованию отрывающего усилия. При недостаточной прочности пленки появляются пузыри с разрывом (рис. 7,б). В оксидной пленке возможно возникновение микропузырей (рис. 7,в), которые препятствуют диффузии ионов металла и могут привести к торможению процесса окисления. Разрушение пленок отслаиванием (рис. 7,г) преимущественно происходит на неровностях поверхности, а растрескивание при сдвиге характерно для пленок с меньшей прочностью, чем их адгезия к металлу. Чаще всего начало разрушения оксидной пленки с отслаиванием наблюдается на углах изделий и их крутых изгибах (рис. 7,е).
Разрушение пленок заметно понижает их защитные свойства пленок и может привести к изменению кинетики окисления.
Параболический закон роста у2 = kτ будет переходить к другой зависимости уn =kτ, где n < 2, а в частном случае, при n = 1 к линейной зависимости, характеризующей полное отсутствие защитных свойств пленки.
Об изменении защитных свойств пленки свидетельствуют резкие изломы на кинетической кривой окисления (рис.8).


 2018-01-08
2018-01-08 2887
2887