Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции.
Кинетическое уравнение реакции только для элементарных стадий совпадает с выражением ЗДМ. В этих случаях молекулярность и порядок реакции совпадают, хотя и не всегда. Так, при избытке одного из компонентов элементарной реакции А + В (А >> В) скорость реакции будет практически зависеть от изменения концентрации вещества В (А = const), поэтому порядок бимолекулярной реакции понижается до первого. Аналогично тому, что скорость реакции может характеризоваться по любому веществу, участвующему в реакции, для реакции a А + b В → кинетические уравнения по веществу А и веществу В выглядят соответственно

|
а общее кинетическое уравнение –
| (5.2) |
Здесь z = x + y – общий порядок реакции. Запишем кинетическое уравнение в дифференциальной форме для разных исходных реагентов:

|
Разделение переменных и интегрирование в пределах от нуля до τ дает приведенные в таб. 5.1 уравнения для реакций первого, второго и третьего порядков.
| ||||||||||||
| Таблица 5.1 Кинетические уравнения и период полупревращения реакций первого, второго и третьего порядков |
Решения кинетических уравнений 2-го и 3-го порядка, приведенные в таблице 5.1, справедливы только при равных начальных концентрациях веществ
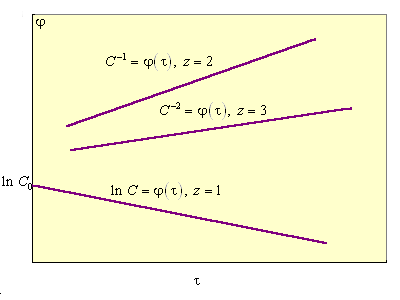
В каждом случае кинетическое уравнение линейно в соответствующих координатах С(τ), что позволяет графически определить порядок реакции (рис. 5.2).
|
| Рисунок 5.2 Зависисмости C = f (τ) для реакций первого, второго и третьего порядков |
Прологарифмировав уравнение (5.2), получим lg V = lg K + z lg C; из графической зависимости (рис. 5.2) получаем lg K и z = tg φ.
Порядок реакции, особенно гетерогенной, может быть не только целочисленным (в том числе и нулевым), но и дробным. Нулевой порядок реакции указывает на постоянство скорости во времени.
Для гетерогенной реакции C(тв) + О2(г) = СО2(г) можно создать концентрационнные условия, при которых порядок реакции будет меняться в пределах от нуля до единицы. Действительно, при больших парциальных давлениях кислорода  в приповерхностном слое твердого углерода большой концентрационный градиент способствует практически мгновенному восполнению прореагировавшего кислорода. Следствием этого оказывается постоянство скорости реакции по кислороду, поскольку
в приповерхностном слое твердого углерода большой концентрационный градиент способствует практически мгновенному восполнению прореагировавшего кислорода. Следствием этого оказывается постоянство скорости реакции по кислороду, поскольку  ~ const. Поэтому реакция горения углерода будет в этих условиях подчиняться кинетическому уравнению нулевого порядка. При уменьшении парциального давления кислорода, начиная с некоторого
~ const. Поэтому реакция горения углерода будет в этих условиях подчиняться кинетическому уравнению нулевого порядка. При уменьшении парциального давления кислорода, начиная с некоторого  скорость реакции будет соответствовать кинетическому уравнению первого порядка
скорость реакции будет соответствовать кинетическому уравнению первого порядка  При промежуточных давлениях кислорода порядок реакции изменяется в интервале от 0 до 1.
При промежуточных давлениях кислорода порядок реакции изменяется в интервале от 0 до 1.

|
| Рисунок 5.3 Зависимость V = f (lg C) |
МОЛЕКУЛЯРНОСТЬРЕАКЦИИ, число частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) р-ции и превращающихся в продукты. Так, для р-ций в р-рах молекулярность реакции не учитывает число молекул р-рителя, образующих сольватную оболочку или мол. комплексы с реагентами, т. к. эти молекулы не входят в состав продуктов р-ции. В р-циях замещения и элиминирования орг. соед., протекающих часто в неск. стадий, молекулярность реакции оценивается как число молекул, претерпевающих хим. превращение в лимитирующей стадии. Соответственно числу реагирующих частиц различают мономолекулярные реакции, бимолекулярные реакции и тримолекулярные реакции, отличающиеся кинетич. закономерностями и механизмом. Как правило, молекуляр-ность простой р-ции совпадает с порядком реакции, однако бывают и несовпадения. Напр., рекомбинации атомовв газовой фазе протекают через тройные столкновения типа  где М-третья частица. Суммарный порядок таких р-ций-третий (скорость u = = k[М][Сl]2, где k-константа скорости), но молекуляр-ность равна 2, т.к. в хим. взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом хим. превращения.
где М-третья частица. Суммарный порядок таких р-ций-третий (скорость u = = k[М][Сl]2, где k-константа скорости), но молекуляр-ность равна 2, т.к. в хим. взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом хим. превращения.
 2018-01-21
2018-01-21 838
838


 [с–1]
[с–1]
 [с–1]
[с–1]
 [л∙моль∙с–1]
[л∙моль∙с–1]
 [л∙моль–1∙с–1]
[л∙моль–1∙с–1]
 [л2∙моль–2∙с–1]
[л2∙моль–2∙с–1]
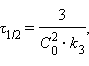 [л2∙моль–2∙с–1]
[л2∙моль–2∙с–1]







