Ответы на вопросы.
1) Химия - наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях. В зависимости от атомарной природы изучаемого вещества, типов химических связей между атомами различают неорганическую, органическую и элементоорганическую химии. Объектом неорганической химии являются все химические элементы и их соединения, другие вещества на их основе. Органическая химия изучает свойства обширного класса соединений, образованных посредством химических связей углерода с углеродом. Химия является общетеоретической дисциплиной. Она призвана дать студентам современное научное представление о веществе как одном из видов движущейся материи, о путях, механизмах и способах превращения одних веществ в другие. Знание основных химических законов, владение техникой химических расчетов, понимание возможностей, предоставляемых химией с помощью других специалистов, работающих в отдельных и узких ее областях, значительно ускоряют получение нужного результата в различных сферах инженерной и научной деятельности.
Атом - предел химического разложения любого вещества.
Молекула - Частица, состоящая из двух или более атомов, которая может самостоятельно существовать.
Вещество - это форма материи, обладающая массой (масса не равна нулю)
Химический элемент - совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам. Простые вещества- молекулы, состоят из атомов одного и того же элемента.
2) Неорганические вещества - это химические соединения, не являющиеся органическими, то есть, не содержащие углерода.
Все неорганические соединения делятся на две большие группы:
Простые вещества - состоят из атомов одного элемента;
Сложные вещества - состоят из атомов двух или более элементов.
Простые вещества по химическим свойствам делятся на: металлы, неметаллы, амфотерные простые вещества, благородные газы.
Сложные вещества по химическим свойствам делятся на: оксиды, основные оксиды, кислотные оксиды, амфотерные оксиды, двойные оксиды, несолеобразующие оксиды, основания, соли, кислоты, амфотерные гидроксиды.
Генетические связи - это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следуюших превращений: металл--основный оксид--щёлочь--соль, например генетический ряд калия K--K2O--KOH--KCl.
2. Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений: металл--основный оксид--соль--нерастворимое основание--основный оксид--металл. Например:Cu--CuO--CuCl2--Cu(OH)2--CuO-->Cu
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде: неметалл--кислотный оксид--растворимая кислота--соль.Например:
P--P2O5--H3PO4--Na3PO4.
2. Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:неметалл--кислотный оксид--соль--кислота--кислотный оксид--неметалл, Например:
Si--SiO2--Na2SiO3--H2SiO3--SiO2--Si.
3) Оксиды - это сложные вещества, состоящие из двух элементов, одним из которых является кислород, играющий более электроотрицательную роль.
Классификация:
В зависимости от химических свойств различают:
Солеобразующие оксиды: основные оксиды - оксиды металлов, степень окисления которых I—II; кислотные оксиды - оксиды металлов со степенью окисления V—VII и оксиды неметаллов; амфотерные оксиды - оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO).
Номенклатура химических соединений развивалась и складывалась по мере накопления фактического материала. Сначала, пока количество соединений было невелико, широко использовались тривиальные названия, специфические для каждого соединения, не отражающие состава, строения и свойства вещества, – сурик (Рb3О4), глет (РbО), жженая магнезия (MgO), железная окалина (Fe3О4), веселящий газ (N2O), белый мышьяк (As2O3).
На смену такой номенклатуре пришла полусистемная, стали указывать количество атомов кислорода, появились термины: «закись» – для более низких, «окись» – для более высоких степеней окисления, «ангидрид» – для оксидов кислотного характера. Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO.
Химические свойства: Основные оксиды
Основный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
Химические свойства: Кислотные оксиды
1. Кислотный оксид + вода = кислота
SO3 + H2O = H2SO4
Химические свойства: Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
ZnO + 2HCl = ZnCl2 + H2O
4) Основания – это электролиты при диссоциации, которых в качестве анионов образуется только гидроксид иона.
Классификация: растворимые (щёлочи), нерастворимые
Названия оснований состоят из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия, Ba(OH)2 – гидроксид бария, Al(OH)3 – гидроксид алюминия т.д. Если металл образует несколько оснований, то указывается валентность (степень окисления) металла римской цифрой в скобках после названия: Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид железа (III), Sn(OH)2 – гидроксид олова (II), Sn(OH)4 – гидроксид олова (IV) и т.д.
Основание NH4OH имеет название гидроксид аммония (NH4+ – катион аммония).
Типичные основания и гидроксид аммония взаимодействуют с кислотами и с кислотными оксидами с образованием солей и воды:
Mg(OH)2 + 2HCl = MgCl2 + 2H2O; Ca(OH)2 + CO2 = CaCO3 + H2O
Взаимодействие щелочей с кислотами называется реакцией нейтрализации.
Амфотерные основания взаимодействуют как с кислотами, так и со щелочами. В реакциях с кислотами они проявляют свойства типичных оснований:
5) Кислоты – это электролиты при диссоциации, которых в качестве катионов образуются только ионы водорода.
Классификация: По составу кислотного остатка кислоты подразделяются на бескислородные и кислородосодержащие.
По количеству катионов водорода в одном моле кислоты подразделяются на одноосновные, двухосновные и многоосновные.
Номенклатура: Названия бескислородных кислот начинаются с названия неметалла с окончанием -о и прибавлением слова водородная: HF – фтор о водородная, HCl – хлор о водородная, HBr – бром о водородная, H2S – сер о водородная. Кислота HCN имеет название циан о водородная.
Названия кислородосодержащих кислот производятся от русских названий кислотоообразующих элементов с различными суффиксами, которые необходимо строго выдерживать.
Если элемент образует две кислоты, то используются суффиксы - н и - ист: первый – при максимальной валентности кислотообразующего элемента, а второй, если валентность не максимальная.
Свойства: В безводном состоянии кислоты представляют собой жидкие (HNO3, H2SO4, HClO4, H3PO4), газообразные (HF, HCl, HBr, HI, H2S) и твёрдые (H2SiO3, H2SnO3, H3BO3) вещества. Большинство из них хорошо растворяются в воде, растворы имеют кислый вкус, разъедают кожу, изменяют цвет индикаторов.
Сильные кислоты взаимодействуют со щелочами с образованием соли и воды. Эти реакции называются реакциями нейтрализации, т.к. кислая среда кислоты и щелочная среда щёлочи превращаются в нейтральную среду воды. Ионное уравнение реакции нейтрализации одинаково, независимо от вида кислоты и щёлочи.
6) Соли – сложные вещества, состоящие из атомов металлов и кислотных остатков. В водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
Классификация:
Соли делятся на 3 группы:
· Средние соли – соли, содержащие только атомы металла и кислотного остатка.
· Кислые соли – соли, образованные многоосновными кислотами. Одноосновные кислоты кислых солей не образуют. Кислые соли помимо ионов металла и кислотного остатка содержат ионы водорода.
· Основные соли – соли, содержащие помимо ионов металла и кислотного остатка гидроксильные группы.
Номенклатура:
Название солей составляется из кислотного остатка и названия металла. Названия кислородосодержащих солей имеют окончания «ат», а названия бескислородных солей – окончание «ид». В некоторых случаях для кислородосодержащих солей используют окончание «ит», например, сульфит натрия.
Свойства:
Диссоциация (средние, двойные и смешанные соли диссоциируют одноступенчато, а кислые и основные соли диссоциируют ступенчато).
Разложение при нагревании( при нагревании некоторые соли разлагаются на оксид металла и кислотный оксид. Соли бескислородных кислот при нагревании распадаются на простые вещества).
Взаимодействие солей с кислотами ( реакция происходит, если соль образована более слабой кислотой или если образуется осадок)
Взаимодействие со щелочами ( со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания)
Взаимодействие друг с другом ( реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок)
Взаимодействие с металлами (каждый предыдущий металл в ряду напряжений вытесняет его из соли)
Электролиз ( соли подвергаются электролизу только в растворах и расплавах)
Взаимодействие с кислотными оксидами
Взаимодействие с индикаторами.
7) Атом – частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Планетарная теория строения атома по Резерфорду:
В 1911 г. Резерфорд предложил планетарное строение атомов: атом состоит из положительно заряженного ядра, где сосредоточена преобладающая часть массы атома и вращается вокруг ядра электрона. Положительный заряд ядра нейтрализуется суммарно отрицательно заряженными электронами. Вследствие чего атом электронейтрален.
Противоречия планетарной теории строения атомов:
· Не смог объяснить длительного и устойчивого существования атомов.
· Электрон, вращающийся вокруг ядра, должен приближаться к ядру, непрерывно меняя скорость своего движения.
· Частица испускаемого света должна быть непрерывной – это не соответствует действительности.
8) Строение атома по Бору:
· Электрон может вращаться вокруг ядра не по любым орбитам, а только по некоторым определенным – они называются стационарными.
· При нахождении электрона на стационарной орбите он не поглощает и не излучает энергию.
· Излучение/поглощение электромагнитной энергии возможно при скачкообразном переходе с одной стационарной орбиты на другую.
Квантово – волновой дуализм электрона:
1) Электрон – это частица
- Электрон имеет массу покоя ( г)
г)
Любая частица магнитного мира может иметь заряд. Электрон имеет заряд
= 
-Эффект Веймана
2) Электрон – это волна:
А) Дифракция
Б) Интерференция
9) Следствие волнового характера движения электрона в атоме является квантовость характеристик этого движения, проявляется появлением некоторой целочисленности параметров, называемых квантовым числом.
Главное квантовое число – N( от 1 до бесконечности) – его величиной определяется возмещение энергии состояния электрона в атоме.
Второе квантовое число – L (орбитально – квантовое число) определяет форму электронного облака, а состояние элемента характеризуется различным значением L - называется энергией подуровня электрона в атоме.
3 квантовое число m – магнитное квантовое число – определяет ориентацию электронного облака в пространстве, т. е. вытянутость его вдоль осей 3-х мерного пространства.
10) Принцип Паули. В одном атоме не может быть 2-х электронов с одинаковым набором всех 4-х квантовых чисел.
Следствие: в одной квантовой ячейки может располагаться 2 электрона, но их спины должны быть антипараллельными.
Правило Хунда. Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетических подуровней, при которых абсолютное значение суммарного спина максимально.
Правило Клечковского. Заполнение электронами энергетических уровней и подуровней в атоме происходит в порядке возрастания значений суммы главного и орбитального квантовых чисел, если же эта сумма одинакова, то заполнение происходит только в порядке возрастания значения главного квантового числа.
11) Периодический закон – свойства простых тел, а также образуемых ими сложных соединений находятся в периодической зависимости от атомных весов элемента.
Графическим отображением периодического закона является периодическая таблица химических элементов (ПСХЭ).
В коротком варианте ПСХЭ имеются группы, делящиеся на подгруппы и периоды, делящиеся на ряды. По горизонтали имеется 7 периодов: 1, 2, 3 – малые; 4, 5, 6 – большие, а 7 – незавершенный.
Все элементы ПС (периодической системы) пронумерованы в том порядке, в каком они следуют друг за другом, номера элементов – порядковые номера. В системе имеется 10 рядов, каждый малый период состоит из 1 ряда, каждый большой из 2 рядов (верх четный, низ нечетный). По вертикали в ПС расположено 8 групп. Номер группы обозначает высшую положительную степень окисления. Каждая группа делится на главную (А) и побочную (В). Главную подгруппу составляют только типичные элементы, побочную только металлы элементов больших периодов.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы ПС делятся на 4 электронных семейства:
-s элементы, у них заполняется S подуровень внешнего энергетического уровня, они начинают каждый период ПС.
-p элементы, у них заполняется P подуровень внешнего энергетического уровня энергии и они располагаются в конце периода 2-6.
-d элементы, у них заполняется d подуровень предвнешнего энергетического уровня. Таких элементов по 10. Они расположены между s и p элементами и образуют вставные декады с 4 по7 периоды.
-f элементы, у них заполняется f подуровень третьего снаружи энергетического уровня, к ним относятся два семейства, вынесенных за пределы ПСХЭ и образуют семейства Лантаноидов и Актиноидов (28 f элементов).
Радиус атома в периодах слева направо уменьшается, в группах сверху вниз увеличивается.
Энергия ионизации в периодах слева направо увеличивается, в группах сверху вниз уменьшается.
12) Химическая связь. Количественные характеристики химической связи:
-энергия связи – выделяется при образовании химсвязи (кДж/моль).
-длина связи – расстояние между ядрами провзаимодействовавших атомов
(нМ=1*10-9м).
-кратность связи – число связующих электронных пар между атомами, образовавшим химсвязь. Чем больше кратность, тем меньше длина и больше энергия связи.
-координационное число – число ближайших соседей (атомов, ионов, молекул) в кристалле.
-валентный угол – угол между прямыми, соединяющими ядра атомов в молекуле.
-дипольный момент – заряд, разнесенный на определенное расстояние, измеряющееся мерой полярности связи.
13) Ковалентная связь образуется между атомами неметаллов. При сближении атомов до определенного расстояния, проявляются силы притягивания между ядром атома и электроном другого, однако это зависит от одинаковости или противоположности спинов. Ковалентная связь образуется при непараллельных спинах с уменьшением потенциальной энергии, дальнейшее сближение атомов приводит к возрастанию потенциальной энергии, что сопровождается интенсивным межъядерным отталкиванием. Если спины параллельны, то химсвязь не образуется. Связь, образованная парой электронов с непараллельными спинами, находящимися между ядрами атомов, называется ковалентной.
14) Сигма связь образующаяся в результате перекрывания электронных облаков вдоль прямой, образующей оси связи.
Пи (π) связь, образованная электронными облаками, ориентированной перпендикулярно оси связи и образует две области перекрывания.
Если число связей между двумя атомами =1, то связь является сигма, а если кратность больше 1, то только одна из связей может быть сигма, а остальные пи связями.
Различают 2 разновидности ковалентной связи:
-ковалентная неполярная, связь в которой электронное облако, образованное общей парой электронов симметрично распределяется в пространстве относительно ядер обоих атомов. Реализуется в гомоядерных молекулах.
-ковалентная полярная, в которой электронное облако, образованное общей парой электронов, смещено к одному атому с большей электроотрицательностью, данная разновидность связи реализуется в гетероядерных молекулах.
-обменный механизм, то есть за счет перекрывания одноэлектронных облаков.
-донорно-акцепторный механизм. Частица, предоставляющая неподеленную электронную пару – донор, а частица, принимающая ее – акцептор. Механизм образования ковалентной связи за чет двух электронного облака одного атома (донора) и свободной орбитали другого атома (акцептора), называется донорно-акцепторным механизмом образования ковалентной связи.
15) Метод валентных связей. Единичную химическую связь образуют два электрона с противоположными спинами, принадлежащие двум атомам.
Гибридизация – явление смешивания и выравнивания электронных облаков по форме и энегрии.
Sp-гибридизация, участвует один s и один p электрон. Приданном типе гибридизации реализуется линейная структура с валентным углом =180.
Sp2. При данном типе реализуется плоскотреугольная структура с валентным углом = 120.
Sp3. Реализуется тетраэдрическая структура с валентным углом = 109 градусов 28 минут.
Sp3d. Реализуется структура тригональной бипирамиды с валентным углом около 90 градусов.
Sp3d2. Реализуется октаэдрическая структура с валентным углом около 90 градусов.
Вопрос №26
Катализатор – вещества изменяющие скорость химических реакций. Химические реакции протекающие с участием катализаторов называются каталитическими.
Катализ бывает двух видов: 1.гомогенный катализ – в котором катализатор и реагирующие вещества находятся в одном агрегатном состоянии.
2.Гетерогеный катализ – в котором катализатор и реагирующие вещества находятся в разных агрегатных состояниях или в твердом состоянии.
Роль катализаторов сводится к уменьшению энергии активности реакции, т.е к снижению высоты энергетического барьера.
(данный материал из интернета, так данная запись отсутствует в моей тетради
Ингибиторы (от лат. inhibeo — останавливаю, сдерживаю) в биологии, природные и синтетические вещества, угнетающие активность ферментов (как в живом организме, так и в бесклеточных системах); различаются по характеру действия, специфичности и др. свойствам. В организме в роли естественных И. ферментов могут выступать продукты обмена веществ. По аналогии с техникой, такое ингибирование называется торможением по принципу обратной связи, так как конечный продукт какого-либо биосинтетического процесса специфически ингибирует одну из первых его стадий. Ингибирование осуществляется либо на генетическом уровне (И., называемый в этом случае репрессором, тормозит биосинтез одного из ферментов, действующих в начале биосинтетической цепи), либо на кинетическом уровне (И., называемый ретроингибитором, снижает активность этого фермента). Ретроингибирование — частный случай так называемой аллостерической регуляции активности фермента. И. широко используются для изучения механизма каталитического действия ферментов, установления природы функциональных групп белков, для выяснения роли различных ферментативных процессов вобмене веществ. И. имеют большое практическое значение. Так, применение ядохимикатов для борьбы с вредными насекомыми и сорняками связано с их способностью ингибировать процессы, жизненно важные для этих организмов (см. ферментные яды). Действие некоторых фармакологических средств и лекарств также основано на ингибировании ферментативных реакций. В более широком смысле термин "И." применяют для обозначения веществ, тормозящих какие-либо сложные биологические процессы (например, ингибиторы ростарастений). См. также Ферментативный катализ,
Вопрос №27
Обратимые и необратимые реакции
Необратимые – реакции которые протекают в одном направлении и заканчиваются полным превращением веществ в продукты реакции
Обратимые- реакции которые протекают в двух взаимо противоположных направлениях
*обратимые реакции не доходят до конца, а заканчиваются установлением химического равновесия.(это состояние когда скорость прямой реакции = скорости обратной реакции)
Константа химического равновесия – величина не зависящая от концетрции веществ, но зависящая от температуры и она показывает во сколько раз скорость прямой реакции больше скорости обратной реакции. В состоянии химического равновесия это химически подвижное динамическое состояние остается неизменным, пока не изменятся внешние условия
Вопрос № 28
Принцип Ле-шателье
Если на систему находящуюся в состоянии химичекского равновесия произвести какое-либо внешнее воздействие то система сместит равновесие в сторону ослабевания внешней системы.
Факторы влияющие на смещение химического равновесия
1. Концестрация – равновесие смещается в сторону меньшей концентрации.
2. Температура – при повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении – экзотермической реакции.
3. Давление(для газообразных веществ) – при повышении давления, равновесие смещается в сторону той реакции которая сопровождается понижением газовых объемов. При понижении равновесие смещается в сторону той реакции которая сопровождается увеличением газовых объемов.
*если число молей газообразных веществ одинаковое, то давление не оказывает смещение химического равновесия
4. Катализатор – ускоряет одновременно как прямую так и обратную реакцию и поэтому не оказывает влияния на смещения химического равновесия
Вопрос №29
Комплексные соединения –соединения образованные сочетанием отдельных компонентов и представляющие собой сложные ионные или молекулы способные с существованию как в кристаллическом состоянии, так и в растворах.
Классификация
1.Катионные комплексы –комплексы в которых внутренняя координационная сфера заряжена положительно.
2.Анионные комплексы- комплексы в которых внутренняя координационная сфера заряжена отрицательно
3.внутресферные комплексы – комплексы в которых отсутствует внешняя координационная сфера
Номенклатура
H2O-аква
NH3-амин
CO2-карбония
1.В комплексном соединении сначала называется анион затем катион
2.Во внутренней координационной сфере сначала указывается количество легандов с помощью греческих числительных
3.Название центрального иона комплексообразователя зависит от типа комплексного соединения. Если сначала катионный то центральный ион называется по Русски в родительном падеже. Если комплекс анионный, то центральный ион комплексообразователя называется по латински с суффиксом -АТ- Если комплекс нейтральный, то ион комплексообразователь называется по Русски в И.п
Теория Вернера
Комплексообразователь
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + n L  [ML n ]
[ML n ]
где M – нейтральный атом, положительно или отрицательно заряженный условный ион, объединяющий (координирующий) вокруг себя другие атомы, ионы или молекулы L. Атом M получил название комплексообразователя или центрального атома.
В комплексных ионах [Cu(NH3)4]2+, [SiF6]2-, [Fe(CN)6]4-, [BF4]-комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III).
Чаще всего комплексообразователем служит атом элемента в положительной степени окисления.
Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота(-III) в катионе аммония [NH4]+ и т.п.
Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO)4] и [Fe(CO)5], содержат атомы никеля(0) и железа(0).
Комплексообразователь (выделен синим цветом) может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например:
Ag + + 2 NH3  [ Ag (NH3)2]+;
[ Ag (NH3)2]+;
Ag + + 2 CN-  [ Ag (CN)2]-
[ Ag (CN)2]-
так и находясь в составе молекулы:
Si F4 + 2 F-  [ Si F6]2-;
[ Si F6]2-;
I 2 + I-  [ I (I)2]-;
[ I (I)2]-;
P H3 + H+  [ P H4]+;
[ P H4]+;
B F3 + NH3  [ B (NH3)F3]
[ B (NH3)F3]
В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах.
Комплексное соединение может включать несколько комплексных ионов, в каждом из которых содержится свой комплексообразователь.
Например, в одноядерном комплексном соединении состава[K(H2O)6][Al(H2O)6](SO4)2 комплексообразователи KI и AlIII, а в[Cu(NH3)4][PtCl6] - CuII и PtIV.
Лиганды
В комплексном ионе или нейтральном комплексе вокруг комплексообразователя координируются ионы, атомы или простые молекулы (L). Все эти частицы, имеющие химические связи с комплексообразователем, называются лигандами (от латинского " ligare " - связывать). В комплексных ионах [SnCl6]2- и [Fe(CN)6]4- лигандами являются ионы Cl- и CN-, а в нейтральном комплексе [Cr(NH3)3(NCS)3] лиганды – молекулы NH3 и ионы NCS-.
Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей.
Лигандами могут быть различные неорганические и органические ионы и молекулы. Важнейшими лигандами являются ионы CN-, F-, Cl-, Br-, I-, NO2-, OH-, SO3S2-, C2O42-, CO32-, молекулы H2O, NH3, CO, карбамида (NH2)2CO, органических соединений – этилендиамина NH2CH2CH2NH2, a-аминоуксусной кислоты NH2CH2COOH и этилендиаминтетрауксусной кислоты (ЭДТА):

и другие.
Дентатность лиганда
Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. Такого рода лиганды получили название монодентатных. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Некоторые распространенные лиганды типа молекул воды H2O, гидроксид-иона OH-, тиоцианат-иона NCS-, амид-иона NH2-, монооксида углерода CO в комплексах преимущественно монодентатны, хотя в отдельных случаях (в мостиковых структурах) становятся бидентатными.
Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными. Это этилендиамин, карбонат-ион, оксалат-ион и т.п. Каждая молекула или ион бидентатного лиганда образует с комплексообразователем две химические связи в соответствии с особенностями своего строения: 
Например, в комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32-- образует две связи с комплексообразователем – условным ионом Co(III), а каждая молекула лиганда NH3 – только одну связь: 
Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты: 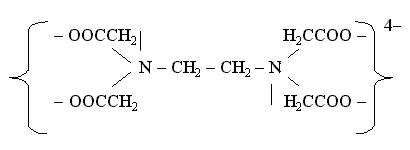
Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома.
 2018-01-21
2018-01-21 2049
2049






