В растворе кроме ионов электролита в процесса могут участвовать молекулы воды.
Восстановительный процесс на катоде зависит от природы электролита и не зависит от материала электрода.
Чем активнее металл, тем труднее он выделяется (восстанавливается) из раствора.
· Катионы малоактивных металлов (от Cu2+до Au3+) практически полностью восстанавливаются на катоде.

· Катионы активных металлов (от Li+ до Al3+) не восстанавливаются на катоде, а вместо них восстанавливаются либо молекулы воды, либо катионы водорода.
 - в нейтральной или щелочной среде pH≥7
- в нейтральной или щелочной среде pH≥7
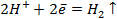 - в кислой среде pH<7
- в кислой среде pH<7
· Катионы металла средней активности (от Ti2+до H+) восстанавливаются одновременно с молекулами воды.

 - pH≥7
- pH≥7
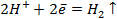 - pH<7
- pH<7
Если водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения алгебраической величины стандартного электродного потенциала соответствующего металла.
Окислительный процесс на аноде зависит не только от природы электролита, но и от материала анода.
|
|
|
Если анод инертный, то окислительный процесс на аноде зависит только от природы электролита.
· При электролизе растворов безкислотных кислот и их солей, за исключением HF и ее солей, на аноде идет процесс окисления аниона: 
· При электролизе щелочей, кислосодержащих кислот и их солей, а аткже HF и ее солей, на аноде происходит выделение кислорода за счет окисления:
 pH>7
pH>7
 pH≤7
pH≤7
· Если анод активный, то есть материал анода может оксиляться, то легче всего происходит процесс окисления самого материала анода: 
 2018-01-21
2018-01-21 2140
2140








