Билет
1.Химиялық темодинамика пәні.Неізгі термодинамикалық түсініктер. Энергия және олардың түрлері. Жүйенің ішкі энергиясы. Энтальпия. Жұмыс және жылу. Термодинамиканың бірінші заңы
Химиялық термодинамика -химиялық реакция кезінде байқалатын энергияның бір түрден екінші түрге айналуын,реакиялардың бағытын және олардың осы жағдайда өздігінен жүру шегін,сонымен қатар химиялық тепе теңдіктің болу жағдайларын анықтайды. Негзгі түсініктер:
Жүйе деп қоршаған ортадан ойша бөлініпн алынған және онымен әрекеттесуде болатын дене не денелер тобын айтамыз.Қоршаған ортамен әрекеттесуіне байланысты жүйелер:
1.Оқшауланған жүйе -Қоршаған ортамен зат және энергия алмаспайды.(дьюар қабырғасына су буы)
2.Жабық жүйе -қоршаған ортамен тек энергия алмасып бірақ зат алмаспайды.(аузы жабық колбаға құйылған су)
3.АшыҚ жүйе-қоршаған ортамен зат та энергия да алмасады(ашық ыдыстағы су)
Жүйе күйі -берілген уақыт мезетіндегі жүйе ие бола алатын физикалық химиялық қасиеттердің жиынтығы.Жүйе күйін сипаттайтын темодинамикалық параметрлер:
1.Негізгі параметрлер-жүйенің әртүрлі қасиеттерін сипаттайды.температура көлем қысым концентрация.
2.Қосымша параметрлер немесе күй функциялары олардың көмегімен жүйе күйін тікелей сипаттай алмаймыз,бірақ бұл шамалардың өзгерістері арқылы процестік жүру мүмкіндігі оның бағыты тепе теңдік күй туралы процестік жүру жағдайына байланысты толық мағлұмат алуға болады.(ішкі энергия,энтропия,энтадьпия,гиббс энергиясы)
Жүйе құрайтын фазалар бірдей агрегаттық күйде болса - біртекті (гомогенді), ал әртүрлі күйде болса - әртекті (гетерогенді) деп бөлінеді.
Жалпы термодинамикалық жүйе тыңғылықты сипаттау үшін, оның физикалық - химиялық қасиеттерінен, яғни көлемі, қысымы, температурасы, химиялық құрамы және т.б. хабардар болуымыз керек. Осы орайда өзімізге таныс күй теңдеулерінің тәуелділігінен өзара байланыста болатын шамалар туралы дәйекті ұғым алуымызға мүмкіндік туындайды.
Аталған күй теңдеулерінде кездесетін айналмалылар күй шамалары (параметрі) деп аталынады.
Кез-келген күй шамаларыныц өзгepici термодинамикалық құбылыс (процесс) деп аталынады да күй шамасының тұрақтылығына қарай төмеңдегіше жіктелінеді:
р = const – изобарлы,
V = const – изохорлы,
Т = const – изотермиялы,
Сыртқы қоршаған ортамен жылу және зат алмаспай жүретін құбылыс – адиабатты деп аталып pVγ = const теңдеуімен өрнектеледі. Мұндағы γ – адиабата көрсеткіші және бұл құбылыс оқшауланған жүйелерде орын алады.
Энергия(гр. energeіa – әсер, әрекет) – материя қозғалысының әртүрлі формасының жалпы өлшеуіші. Энергия екіге бөлінеді: потенциалдық және кинетикалық энергия.
Потенциалдық энергия денелердің немесе дене бөліктерінің өзара алмасуынан пайда болады. Кинетикалық энергия дене қозғалысқа түскенде пайда болады.
Ішкі энергия - жүйенің толық эенргиясы ондағы барлық бөлшектердің (атом, молекула, ион және т.б) потенциалдық және кинетикалық энергияларының қосындысы.
U = E k + E pot Энергияны сипаттау үшін жұмысын, жнергиясын өлшеп беруіміз қажет.
Энтальпия - Термодинамикалық функция, изобаралық – изотермиялық (энергия қоры) жағдайдағы жүйенің энергетикалық күйін сипаттайды. H = U + p V
Жүйе бір күйден екінші күйге өткенде H өзгерісін анықтауға болады. H= H2-H1
Термодиннамика бірінші бастамасы Q= U +A
Жүйе келтірілген жүй оның ішкі энергиясын арттыруға және сыртқы жұмыс жасауға жұмсалады.
І бастамасы: жылулық құбылыстармен жүретін үдерістер үшін энергия сақталу заңының бір көрінісі.
Жұмыс -жүйенің сыртқы параметрлерін өзгерту арқылы алынған немесе берілген энергия көрсеткіші.
Термодинамиканың бірінші тануының негізгі түрі былай айтылады:
1. Түрлі энергиялар бір-біріне тең эквиваленттілік қатынаста айналады.
2. Оңашаланған күйде энергияның әр түрінің қысымы өзгермейді.
3. Бір түрден екінші түрге айналғанда энергия жоғалмайды да, жаңадан пайда болмайды.
4. Жұмысты жоқтан шығаратын машина жасау мүмкін емес.
2. VIII B тобының d элементтері. Темір кобальт қосылыстарының химиялық қасиеттері. Тірі организмдегі мөлшері және биологиялық әсері.
D-элементтердің химиялық сипаты сыртқы электрон қабатында 2s электрон (кейде 1s электрон) болатын атомдардың электрондық құрылысымен анықталады. Кезекті электрондар сыртқы электрондық қабаттан санағанда ішкері екінші қабатқа түсіп, d-деңгейшені толтырады. Бұл элементтер атомдардың сыртқы электрондары ядромен әлсіз байланысқан, оған иондану энергиясы шамасының төмендігі айғақ.
Сондықтан d-элементтер химиялық реакцияларда металдар сияқты оң тотығу дәрежесiн көрсетеді.
Периодтарда d-элементтер типтік металдар мен типтік бейметалдар арасында орналасқандықтан, оларды ауыспалы элементтер деп атайды. Ауыспалы элементтердiң периодтарында реттік нөмірі өскенде сыртқы электрондық кабаттың кұрылысы өзгермейдi (сыртынан санағанда d- деңгейімен электрондар саны ғана өзгередi). Нәтижесiнде бұл элементтердiң қасиеттері негiзгi топша элементтеріне қарағанда аз өзгередi. Топтарда косымша топша элементтерiнiң металдық қасиеттері реттік нөмірі өскенде кемидi де, V жене VI период металдарының қасиеттерінде бiршама ұқсастықтар байқалады.
Ауыспалы элементтердiң атомдары химиялық байланыс түзу үшiн сыртқы деңгейдегі электрондарды ғана емес, сонымен бiрге d-электрондар мен сырттан санағанда екiншi деңгейдің бос орбитальдарын пайдаланады. Сондықтан оларға ауыспалы тотығу дәрежелерi және әртүрлi оксидтер, гидроксидтер және басқа қосылыстар түзу тән. Бұл кезде қосылыстарда d-элементтерi жоғары тотығу дәрежесiн көрсетеді, тура осындай тотығу дәрежесiн көрсететін негiзгi топшалардағы бейметалдардың қосылыстарына өте ұқсас болады.
Маңызды d-элементтер: мыс, мырыш, хром және темір.[1]
VIII B тобының жеңіл элементтері- темір, кобальт пен никель – темір муыстастығына біріктіріледі. Бұл элементтер бір-біріне өздерінің ауыр аналогтарына қарағанда жақынырақ келеді.
Темір (лат. Ferrum)[2] — Менделеевтің Периодтық кестесінің 4-ші периодының 8-ші қосымша тобындағы химиялық элемент; Алюминийден кейін жер қабатындағы ең кең таралған металл. Металдар қатарына жататын химиялық белсенді элемент. Темір екі жағдайда кездеседі. Оның бірі — жердің өзінен пайда болған жерлік (теллурлық) темір, екіншісі — аспаннаң метеорит түрінде жерге түскен космостық темір. Рет нөмірі - 26, атомдық массасы - 55,847
Химиялық қасиеттері
· Темір атомының құрылысы: 26 электрон, 26 протон, салыстырмалы атомдық массасы 56, 30 нейтрон, 4 электрондық қабат, 2) 8) 14) 2),
· Электрондық конфигурациясы: 1s2 2s2 2p6 3s2 3p6 3d6 4s2
· Тотығу дәрежесі 0,+2,+3, кейде +6; тотықсыздандырғыш болып табылады.
· Жай заттармен және күрделі заттармен реакцияға түседі. Таза темір магниттелуге, тез магниттік қасиеттерін жоюға бейім. Сондықтан оны трансформаторлар, электромоторлар, электромагниттер, және микрофон мембраналарын жасауға қолданады. Темір көбінесе болат және шойын құймалары түрінде пайдаланылады.
Биологиялық маңызы:
Бұл элементтің рөлі денсаулық үшін өте зор. Егер темір жетіспесе, баршамызға белгілі анемия немесе қаназдық ауруы пайда болады. Бұл элементтің ағзадағы тәуліктік мөлшері — 11-30 мг. Адам қанында 3 грамға жуық темір бар. Оның мөлшері көрсетілген шамадан төмен болса, қанның қызыл жасушасының, яғни, гемоглобиннің түзілуі бұзылып, тыныс алу қызметі нашарлайды. Темір ағзаға сырттан түседі, тамақтың құрамындағы темір ионы он екі елі ішектің жоғар-ғы бөлігінде қанға сіңеді. Темірдің ағзаға дұрыс сіңбеуі асқазандағы тұз қышқылының жетіспеуінен немесе темірдің ақуызбен байланысының нашарлауынан болады. Ал тұз қышқылының жетіспеуінің өзі бауыр мен өт жолдарының дұрыс қызмет атқармауынан деуге болады, яғни, оларда әр түрлі тұздар тас түрінде жиналады. Тастардың пайда болуы топырақ пен судың және қоректің сапасына байланыс-ты екендігі түсінікті.
· Темір жетіспеген кезде тері бозарады, тырнақ жұмсарады, әрі тез сынады, ауыз қуысы және ас-қазанның сілекейлі қабаты бүлінеді.
· Темір жұмыртқаның сарысында, қарақұмықта, грек жаңғағында, күнжіт, фасоль, өрікте, мейізде көп болады.
· Адам денесінде темір құрамы 3 - 7 гр дейін (ткань, қан, ішкі органдарда) болады. Темір біздің организмге тамақ арқылы келеді. Ересек адамның тәулік қажеттілігі 11 - 30 мг құрайды.
· Бұлшықет ақуызы – миоглобин, құрамында Fe+3 катионы етке қызғылт түс береді. Қан белогы – гемоглобин, құрамында Fe+2 катионы, қанға қызыл түс береді, сүйек кемігінде түзіледі.
· Темір барлық жасыл өсімдіктер құрамына кіреді, хлорофилл түзуге, тыныс алуға қатысады.
КОБАЛЬТ, Co – элементтердің периодтық жүйесінің VIII тобындағы химиялық элемент, атомдық нөмері 27; атомдық массасы 58,933. Кобальт – күміс түсті ауыр металл, балқу t 1494°С; қайнау t 2960°С; тығыздығы 8,9 г/см3. Табиғатта тұрақты 2 изотопы (59Co және 57Co) және бір радиоактивті 60Со изотопы (жартылай ыдырау периоды 5 жыл) бар.
Химиялық қасиеті:
Таза түріндегі кобальт - қызылдау түрі бар қатты ақ металл, ол мұнымен қатар соққыланғыш, созылғыш және магнитті. Табиғи кобальт тұрақты бір изотопты Со тұрады, ал жасанды жолмен алынған радиобелсенді изотоптардың маңыздысы СО. Осының негізінде біраз аспаптар құрастырылған, өйткені ол күшті ү- сәуле шығарғыш. Бұл изотопты медицинада әсіресе зиянды ісіктерде анықтау және емдеу үшін пайдаланады. Кобальт химиялық белсенділігі бойынша темірден гөрі әлсіздеу. Өзінің қосылыстарыңда +2 және +3 валенттілік көрсетеді. Алдын ала ұнтақтадалған кобальт қыздырғанда өздігінен тұтануы мүмкін. Ол көміртекпен, кремниймен, бормен бірге балқытылғанда карбитті,силицитті және боридті түзеді. Гологендермен жеңіл әрекеттеседі, бірақ оттекпен тек 300 C тотығады. Кобальт сілтілермен іс жүзінде әрекеттеспейді, ал сұйытылған қышқылдарда (тұз, және күкірт, азот және қымыздық) бау ериді. Салқында концендірленген күкірт және азот қышқылдары металлды пассивтендіреді ал қыздырса реакция жеңіл жүреді: С о +4НNO3 () = C(NO3)+ 2NO2+ 2H2O Кобальт сульфиді СоS – іс жүзінде суда ерімейтін, қара тұңба.
2билет
1. Термодинамиканың екінші заңы. Энтропия. Химиялық реакцияның бағытын анықтайтын термодинамикалық факторлар. Гиббстің бос нергиясы.
dS ≥ dQ/T.
теңдеу термодинамиканың 2-ші бастамасының аналитикалық теңдеуі. Осы теңдеуге байланысты термодинамиканың 2-ші бастамасының анықтамасы: жүйенің экстенсивті қасиеті (күй функциясы) – энтропия, дифференциал кезінде қайтымды тепе-тең процесте элементарлы келтірілген жылуға, ал өздігінен қайтымсыз жүретін процесте одан үлкен болатын шама.
- Энергияның бір бөлігі ғана өзгеруге және пайдалы жұмыс жасауға қабілетті, ал екінші бөлігі байланған күйде болады, яғни құнсызданады;
- Оқшауланған жүйелерде тек энтропияның өсуімен жүретін үдерістер жүре алады және олар өздігінен тек берілген жағдайда энтропиясы максимал болатын.
Энтропия – жүйенің реттілік өлшемі. Энтропия мәні жоғары болған сайын, жүйе соғұрлым ретсіз, энтропия мәні төмен болған сайын, соғұрлым жүйе ретті және құрылымданған болады. Оқшауланған жүйеде (қоршаған ортамен энергия алмаспайды) тек энтропия өсетін процестер жүреді.
Энтропия – экстенсивті шама (ол жүйенің массасы мен көлеміне пропорционал) және жылусыйымдылық факторы. Көлем өзгермей ұлғаю жұмысы да болмайды (δW = PdV), жылу тасымалданбаса, энтропия да өзгермейді
δQ = TdS.
Энтропия процестің бағыты мен шегін анықтайды. Қайтымсыз процесте жүйе мен сыртқы орта әрекеттесу нәтижесінен пайда болған жылумен қатар жүйеде δQ’ қосымша энергия пайда болуынан жүйенің ішінде өздігінен өзгерістер болады. Ішкі жүйеде қайтымсыз процестің өтуіне себеп болған бұл жылуды Клаузиус компенсацияланбаған жылу деп атайды. Қайтымсыз процеске термодинамиканың екінші заңы төмендегідей жазылады
dS = dQ/T + δQ’/Т,
Термодинамикалық жүйенің күйін анықтайтын шаманың бірі энтропия болып табылады. Энтропия зат молекулаларының қозғалысының тәртіпсіздігінің мөлшері болып табылады. Өлшем бірлігі 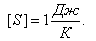
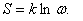
мұндағы:  - күй ықтималдығы.
- күй ықтималдығы.
 .
.
Қайтымды тұйық процесте энтропиялық өзгерісі нольге тең.
Гиббс бос энергиясы
Жекеленген жүйелерде химиялық реакция кезінде энтропияның өзгеруі реакцияның қайтымды не қайтымсыз екенін болжауға мүмкіндік береді. Егер химиялық өзгерістерөздігінен жүретін болса, энтропияның шамасы оң, ал химиялық реакциялар қайтымды болса, онда энтропия нольге тең болады.
Химиялық үдерісте 1 мезгілде екі тенденция орын алады : энтальпия төмендейді (бөлшектердің іріленуге ұмтылуы) және энтропия өседі (бөлшектердің ыдырауға ұмтылуы)
Тұрақты қысым және температура кезінде бір-біріне қарама-қарсы екі тенденцияның қосындысы изобаралық-изотермиялық потенцияалдар G өзгеруін сипаттайды.
G = H ушб – T* S ушб
2. Адам ағзасындағы макро және микроэлементтер. Адам организміндегі мөлшері және биологиялық ролі. ПЖ І А және ІІ А топтарының s- эленменттері. Тірі организмдегі мөлшері және биологиялық әсері.
1. Макроэлементтер. (оттек, сутек, көміртек, азот, фосфор, күкірт, кальция, магний, натрий және хлор) ағзалардағы мөлгері 10 % жоғары болады.
2. Микроэлементтер (йод, мыс, мышьяк, фтор, бром, стронций, барий, кобальт) ағзадағы мөлшері 10 – 15 %
Сілтілік металдар І топшада орналасқан: литий Li, натрий Na, калий К, рубидий Rb, цезий Cs, франций Fr. Франций - радиобелсенді элемент. Олардың валенттілік электрондарының жалпы формуласы ns1 (n = 2-7). Олардың топтық атауы - сілтілік металдар — сумен әрекеттескенде күшті негіз - сілті түзуіне байланысты қойылған.
Сілтілік металдарда валенттілік электрондары s-деңгейшесінді орналасқан, сондықтан оларды s-элементтері деп те атайды. S элементтері қалыпты жағдайда кристалдық күйде болады, басқа металдарға қарағанда тығыздықтары төмен (27-кесте). Литий, калий және натрий судан жеңіл (0,53 - 0,86 г/см3), сондықтан су бетінде қалқып жүреді. Олардың балқу және қайнау температуралары төмен, бұл олардың кристалдық торларындағы металдық байланыстың әлсіз болуынан. Бұл металдар және олардың қосылыстары жалын түсін төмендегідей өзгертеді: литий — кармин қызыл, натрий - сары, калий - күлгін түске бояйды.
Бұл элементтердің сыртқы электрондық қабаттарында тек бір ғана электрондары бар, оларды оңай беріп жіберіп, өзінің алдында тұрған бекзат газдардың аяқталған электрондық құрылысын қабылдайды. Қосылыстарында үнемі бір валентті, тотығу дәрежелері -0, + 1, күшті тотықсыздандырғыштар. Тотықсыздандырғыштық қасиеттері топ бойынша жоғарыдан төмен қарай артады, себебі атом радиустары осы бағытта өседі. Литий сумен енжарлау, ал натрий белсендірек, калий шабытты әрекеттессе, рубидий қопарылыс бере реакцияласады. Бұл элементтердің оксидтері – негіздік оксидтер, ал гидроксидтері суда жақсы еритін сілтілер, олардың қасиеттері жоғарыдан төмен қарай артады.
ІА – топтың негізгі топшасындағы – литий, натрий, калий, рубидий, цезий және франций сілтілік металдар деп аталады, электрондық конфигурациясы – nS1.
ІІА топтың негізгі топшасындағы кльций, стронций, барий және радий сілтілік жерметалдар деп аталады, электрондық конфигурациясы – nS2.
ІА – элементтерінің сыртқы электрондық қабатында бір S1-электрон ядромен әлсіз байланысты болатындықтан, оны беріп жіберіп, күшті тотықсыздандырғыщ қасиет көрсетеді:
Барлық қосылыстарында иондық байланыс түзеді және тотығу дәрежелері тұрақты +1-ге тең болады.
ІІА-элементтерінің сыртқы электрондық қабаттарында жұптасқан екі S-электрон болады (nS2), қоздырғанда бір электрон басқа р-орбитальға ауысып, тұрақты +2 тотығу дәрежесін көрсетеді. Сілтілік жерметалдар да күшті тотықсыздындырғыштар, бірақ сілтілік еталдарға қарағанда активтіктері төмен, радустары кіші және иондану энергиялары жоғары. Жоғарыдан төмен қарай топ бойынша сілтілік және жер сілтілік металдаожың негіздік, тотықсыздандырғыш қасиеттері артады. Сілтілік және жерсілтілік металдар активті болғандықтан жер қыртысында тек қосылыс түрінде кездеседі.
ІА тобындағы s-элементтер негізінде жасалған дәрілік препараттар медицинада қолданылады.
1. Li2CO3 – литий карбонаты. Әр түрлі жүйке ауруларын емдеуде қолданылады.
2. NaHCO3 – натрий гидрокарбонаты – асқазан сөліндегі тұз қышқылын тез арада бейтараптандырады.
3. Na2SO4 /. 10H2O – натрий сульфатының декагидраты – ішті жүргізетін зат ретінде қолданылады.
4. Na2B4O7 . 10H2O – натрий тетраборатының декагидраты – шаюда, жағуда, антисептикалық зат ретінде қолданылады.
7. NaI – натрий иодиді – иод препараты сияқты эндемиялық жемсау ауруында қолданылады.
8. KCl – калий хлориді – ағзада электролит алмасуы бұзылғанда, сонымен қатар жүрек соғысы бұзылғанда қолданылады.
9. КІ – калий иодиді – иод препараты сияқты жемсау ауруына қарсы қолданылады.
10. KMnO4 – калий перманганаты – жараларды жуудағ тамақ және ауызды шаюда антисептикалық препарат ретінде қолданылады.
Берилий. Берилийдің қосылыстары улы. Оның ішінде берилийдің ұшқыш қосылыстары және шаңдағы берилий қосылыстары улы болып келеді. Қоршаған ортада мөлшері аз болса да, бериллоз (берилді рахит) ауруына әкеліп соқтырады.
Магний. Салмағы 70 кг адам ағзасында 42 г магний болады, оның жартысынан көбі сүйек ұлпаларында болады. Адамға күніне шамамен 400 мг магний керек. Магний фосфат түрінде сүйек және тіс ұлпаларында болады. Сүйектегіден басқа магний жасушалар ішінде болады
Кальций. Бұл адам ағзасында көптеу таралған элементтердің бірі. Салмағы 70 кг адам ағзасында кальцийдің 1700 г болады.Кальций сүйек ұлпасының басты элементі, қан ұю механизмдеріне қатысады, ағзадан ауыр металдардың бөлініп шығуына жағдай жасайды, антиоксиданттық қызмет атқарады.Кальцийдің ағзада болатын негізгі массасы сүйектер мен тісте болады. Сүйек құрамына термодинамикалық және кинетикалық тұрақты кальций фосфаты жіне кальций гидроксидінің фосфаты (Са5(РО4)3ОН) кіреді. Сүйек құрамынан басқа 1%кальций жүрек тамырлары мен жүйке жүйелерінің жұмыс жасауда маңызы зор.Кальций жетіспеушілігі гипертоникалық кризиске, жүктілік токсикозына шалдықтыруы мүмкін, холестериннің қандағы деңгейін жоғарылатады, сүйектердің механикалық мықтылығын төмендететін остеопорозды дамытуы, жүйке жүйесінің қозуын жоғарылатуы, шашты түсіруі мүмкін.
Барий. Барийдің биогенді маңызы аз зерттелген. Суда және қышқылдарда еріген барий тұздары улы болады. Қышқылдар мен суда ерімейтін күкіртқышқылды барий рентген сәулелерін жақсы жұтады, сондықтан оны асқазан мен ішекті зерттеуде қолданады.
Стронций. Жануарлар мен адамдар ағзасында стронций сүйек ұлпаларында жиналады және сүйектің сынғыштығына «стронцийлі рахиттің» пайда болуына әкеледі. Сүйектен стронцийді шығару мүмкін емес.
ІІА тобының s-элементтері
1. MgO – магний оксиді (магнезия) – асқазан сөлінің қышқылдығы жоғарылап кеткенде қолданылады.
2. MgSO4 . 7H2O – магний сульфатының гептагидраты – иммунды нерв жүйесін тыныштандыратын қасиетіне байланысты ұйықтататын немесе нашақорлық әсері бар.
3. CaCi2 . 6Н2О – кальцийдің гексагидрат хлориді – аллергиялық ауруларда қолданылады.
4. 2СаSO4 . H2O – кальций сульфатының жартылай гидраты – сумен араластырғанда, тез арада қатып қалады. Осы қасиетіне байланысты гипс сынған сүйекті таңу үшін және тісті протездеуде қолданылады.
ВаSO4 – барий сульфаты – рентген айқындауда қолданылады.
3 билет
1. Химиялық кинетиканың міндеттері. Химиялық реакция жылдамдығы. Химиялық реакция жылдамдығына әсер ететін факторлар. Жай реакциялардың кинетикалық жіктелуі. Нөлінші, бірінші ретті реакциялар. Биологияда жартылай өткізу түсінігі.
Химиялық кинетика - химиялық реакцияның жылдамдығын және оған әртүрлі факторлардың әсерін, реакцияның жүру мезанизмін зерттейді.
Химиялық реакцияның жылдамдығы - белгілі бір уақытта әрекеттесетін заттар мөлшерінің өзгеруін айтады.
Химиялық реакцияның орташа жылдамдығы: 
Химиялық реакциялардың жылдамдығына әсер ететін негізгі факторларға әсер етуші заттардың концентрациясы, температура, катализатордың болуы жатады.
Концентрация
Әсер етуші заттардың концентрациясын жоғарылату — үдерістерді қарқындатудың ең кең тараған тәсілдерінің бірі.
Химиялық реакция жылдамдығының концентрацияға байланыстылығы салмақ әсері заңымен анықталады. Мысалы, сірне(патока) өндірісінде тұз қышқылын(хлорсутек қышқылы) натрий карбонатымен нейтралдау реакциясы үшін жылдамдық келесі теңдеу бойынша жазылады:
2НС1 + Na2C03 = 2NaCl + H20 + С02,
Жылдамдық тұрақтысы(константа скорости) әсер етуші заттардың табиғатына, температурасына, катализатордың болуына байланысты және химиялық реакцияға қатысатын заттардың концентрациясына байланысты емес. Реакция жылдамдығының тұрақтысы реакцияның реті мен молекулярлығына байланысты.
Реакцияның молекулярлығы химиялық әсерлесуге қатысатын молекула санымен анықталады. Егер ол үшін бір молекула қажет болса реакция мономолекулалы деп аталады. Мысалы, мұндай реакцияға қантқызылшасы зауытындағы жоғарғы температурада әкті күйдіру кезіндегі СаС03 ыдырау реакциясы жатады:
СаСО3 = СаО + С02.
Екі молекуланың қатысуымен жүретін реакция бимолекулалы, үш молекуламен — үшмолекулалы деп аталады. Бұл бір заттың немесе әртүрлі зат молекулалары болуы мүмкін. Жоғарыдағы тұз қышқылының натрий карбонатымен өзара әрекеттесу реакциясы үшмолекулалы реакцияға жатады(тұз қышқылының екі молекуласы және натрий карбонатының бір молекуласы).
Температура
Температура — реакцияның жылдамдығын анықтайтын маңызды фактор.
Температура жоғарылаған сайын реакцияның жылдамдығы да өседі, бұл реакция жылдамдығы тұрақтысының жоғарылауымен байланысты.
Вант-Гофф ережесіне байланысты температураны 10оСқа жоғарылату реакция жылдамдығын 2...4 есе жылдамдатады. Бұл ереже 0 ден 300оС температура аралығында жүретін реакцияларға қолданылады.
Химиялық реакция жүру үшін әсер етуші заттар молекуласындағы ішкі молекулалы байланыстарды үзу қажет. Егер бір бірімен соқтығысатын молекулалардың байланысты үзе алатындай энергиясы болса, онда реакция жүреді, ал егер молекула энергиясы қажетті энергиядан аз болса, онда соқтығысу тиімсіз болып реакция жүрмейді.
Температураны жоғарылатқан кезде белсенді молекулалар саны өседі, олардың арасындағы соқтығысу саны да жоғарылап, нәтижесінде реакция жылдамдығы тез болады. әсер етуші заттар концентрациясын жоғарылатқан сайын соқтығысудың жалпы саны көбейіп, нәтижесінде реакцияның жылдамдығы тез өседі.
Катализатор
Катализатор деп реакция жылдамдығын өзгертетін және реакция нәтижесінде өзгеріссіз қалатын заттарды айтады.
Егер катализатор реакция жылдамдығын арттыратын болса, оны ОҢ. Ал баяулайтын болса. ТЕРІС катализатор деп айтады.
Егер катализатор реакция барысында түзілсе, оны АВТОКАТАЛИЗ деп атайды.
Кейбір заттар катализаторлың әсер етуіне кедергі жасайды, ондай заттарды ИНГИБИТОРЛАР немесе КАТАЛИЗАТОР УЛАРЫ дейді.
Кейбір заттар өздері катализатор болмаса да, катализатордың активтігін арттырады, ондай заттарды АКТИВАТОРЛАР дейді.
Реакцияға қатысатын заттар мен катализатор бірдей агрегаттық күйде болса, ГОМОГЕНДІ КАТАЛИЗ, әртүрлі агрегаттық күйде болса, ГЕТЕРОГЕНДІК КАТАЛИЗ деп атайды.
Жай реакциялар бір типті элементарлық актілер арқылы жүзеге асады. Эленментарлық акт – реакция өнімдерінің немесе аралық заттардың жаңа бөлшектерін түзетін бөлшектердің әрекеттесуінің немесе өзгерісінің жекелеген актін айтады.
Нөлінші ретті реакциялар:
1) Жылдамдығы жұтылған жарықтың мөлшеріне тәуелді фотохимиялық реакциялар;
2) жылдамдығы тек қана катализатордың концентрациясына тәуелді катализдік реакциялар;
3) бастапқы заттың азаюы үнемі оның басқа фазадан келіп түсуімен толықтырылып отыратын реакциялар. Көптеген ферменттік реакциялар нөлінші ретпен жүреді. -dc/dt = K; осыдан: c0-c1=kt (t 0.5 = c / 2k)
Бірінші ретті реакциялар үшін: - dc/dt = kc немесе dc/c=-kdt (t 0.5 = ln2/k = 0.69/k)
Жартылай өткізгіштер электр өткізгіштігін зоналық теория негізінде тек кванттық механика жан – жақты түсіндіріп бере алады.
2. d-элементтері Мыс және күміс элемент химиялық қасиеттері. Тірі организмдегі мөлшері, биологиялық ролі.
D-элементтердің химиялық сипаты сыртқы электрон қабатында 2s электрон (кейде 1s электрон) болатын атомдардың электрондық құрылысымен анықталады. Кезекті электрондар сыртқы электрондық қабаттан санағанда ішкері екінші қабатқа түсіп, d-деңгейшені толтырады. Бұл элементтер атомдардың сыртқы электрондары ядромен әлсіз байланысқан, оған иондану энергиясы шамасының төмендігі айғақ.
Сондықтан d-элементтер химиялық реакцияларда металдар сияқты оң тотығу дәрежесiн көрсетеді.
Периодтарда d-элементтер типтік металдар мен типтік бейметалдар арасында орналасқандықтан, оларды ауыспалы элементтер деп атайды. Ауыспалы элементтердiң периодтарында реттік нөмірі өскенде сыртқы электрондық кабаттың кұрылысы өзгермейдi (сыртынан санағанда d- деңгейімен электрондар саны ғана өзгередi). Нәтижесiнде бұл элементтердiң қасиеттері негiзгi топша элементтеріне қарағанда аз өзгередi. Топтарда косымша топша элементтерiнiң металдық қасиеттері реттік нөмірі өскенде кемидi де, V жене VI период металдарының қасиеттерінде бiршама ұқсастықтар байқалады.
Ауыспалы элементтердiң атомдары химиялық байланыс түзу үшiн сыртқы деңгейдегі электрондарды ғана емес, сонымен бiрге d-электрондар мен сырттан санағанда екiншi деңгейдің бос орбитальдарын пайдаланады. Сондықтан оларға ауыспалы тотығу дәрежелерi және әртүрлi оксидтер, гидроксидтер және басқа қосылыстар түзу тән. Бұл кезде қосылыстарда d-элементтерi жоғары тотығу дәрежесiн көрсетеді, тура осындай тотығу дәрежесiн көрсететін негiзгi топшалардағы бейметалдардың қосылыстарына өте ұқсас болады.
Маңызды d-элементтер: мыс, мырыш, хром және темір.[1]
Мыс- Cu – элементтердің периодтық жүйесінің І-тобындағы химиялық элемент, атомдық нөмірі 29, атомдық массасы 63,546.
Химиялық қасиеттері:
{\displaystyle ~\mathrm {Cu{\xrightarrow {NH_{3}\cdot H_{2}O,O_{2}}}\ [Cu(NH_{3})_{2}]OH\rightleftarrows \ [Cu(NH_{3})_{4}](OH)_{2}} } Ауада ылғалсыз және диоксид көмірсутегі болмаған жерде өзгермейді. Су қосылған тұз қышқылымен әрекеттеспейді. Оттегі қоспасының нәтижесінде ерітіндіге айналады. Мыс концентрленген күкірт және азот қышқылымен, патша арағымен, оттегімен, галогендермен, халькогендермен, металл еместердің оксидтерімен тотығады. Қыздыру нәтижесінде галогенсутектермен әрекеттеседі. Мыс ылғалды ауада негізгі мыс карбонатын(II) құрап, тотығады:
{\displaystyle ~\mathrm {2Cu+H_{2}O+CO_{2}+O_{2}\longrightarrow \ Cu_{2}CO_{3}(OH)_{2}\downarrow } }
Мыс концентрленген суық күкірт қышқылымен әрекеттеседі:
{\displaystyle ~\mathrm {Cu+H_{2}SO_{4}\longrightarrow \ CuO+SO_{2}\uparrow \ +H_{2}O} }
Мыс концентрленген ыстық күкірт қышқылымен әрекеттеседі
{\displaystyle ~\mathrm {Cu+2H_{2}SO_{4}\longrightarrow \ CuSO_{4}+SO_{2}\uparrow \ +2H_{2}O} }
Мыс 200 °C та сусыз күкірт қышқылымен әрекеттеседі.:
{\displaystyle ~\mathrm {2Cu+2H_{2}SO_{4}\ {\xrightarrow {200^{o}C}}\ Cu_{2}SO_{4}\downarrow +SO_{2}\uparrow \ +2H_{2}O} }
Мыс, күкірт қышқылын және оттегін ауада қыздырған кезде мыс сульфаты мен су бөлініп шығады:
{\displaystyle ~\mathrm {2Cu+2H_{2}SO_{4}+O_{2}{\xrightarrow {t^{\circ }}}\ 2CuSO_{4}+2H_{2}O} }
Мыс концентрленген азот қышқылымен әрекеттеседі:
{\displaystyle ~\mathrm {Cu+4HNO_{3}\longrightarrow \ Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O} }
Су қосылған азот қышқылымен әрекеттеседі.:
{\displaystyle ~\mathrm {3Cu+8HNO_{3}\longrightarrow \ 3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O} }
Мыс патша арағымен әрекеттеседі:
{\displaystyle ~\mathrm {3Cu+2HNO_{3}+6HCl\longrightarrow \ 3CuCl_{2}+2NO\uparrow +4H_{2}O} }
Оттегінің қатысуымен су қосылған тұз қышқылымен әрекеттеседі:
{\displaystyle ~\mathrm {2Cu+4HCl+O_{2}\longrightarrow \ 2CuCl_{2}+2H_{2}O} }
Мыс 500—600 °C та газ тәріздес тұз қышқылымен әрекеттеседі:
{\displaystyle ~\mathrm {2Cu+4HCl+O_{2}\ {\xrightarrow {500-600^{o}C}}\ 2CuCl_{2}+2H_{2}O} }
Мыс бромсутекпен әрекеттеседі:
{\displaystyle ~\mathrm {2Cu+4HBr\longrightarrow \ 2H[CuBr_{2}]+H_{2}\uparrow } }
Мыс оттегінің қатысуымен концентрленген сірке қышқылымен әрекеттеседі:
{\displaystyle ~\mathrm {2Cu+4CH_{3}COOH+O_{2}\longrightarrow \ [Cu_{2}(H_{2}O)_{2}(CH_{3}COO)_{4}]} }
Мыс концентрленген аммоний гидроксидінде аммиак түзеді:
{\displaystyle ~\mathrm {Cu{\xrightarrow {NH_{3}\cdot H_{2}O,O_{2}}}\ [Cu(NH_{3})_{2}]OH\rightleftarrows \ [Cu(NH_{3})_{4}](OH)_{2}} }
Биологиялық ролі:
Мыс жоғарғы санатты өсімдіктер мен жануарларға қажетті элементтің бірі болып табылады. Қанда мыс церулоплазмон белогымен тасымалданады. Ішекте сіңірілген мыс бауырға альбуминнің көмегімен тасымалданады. Сонымен қатар мыс өте көп мөлшерде ферменттердің құрамында бар. Мысалы цитохром-с-оксидазада. Мыс пен мырышы бар супероксид дисмут ферментінде және деоттегін тасымалдайтын гемоцианин белогында бар. Малюскалар мен көпаяқтыларда мыс темірдің орнына оттегіні тасымалдайды. Мыс пен мырыш асқазан жолдарындағы өңделу кезінде бірімен-бірі бәсекелес деп болжанады. Сондықтан екеуінің біреуі ас құрамында көп болса екіншісінің азаюына алып келеді. Дені сау адамға күніне 0,9 мг мыс қажет.
Егер ағзада мыс жетіспесе, бауырда қорланған темір гемоглобинмен байланысқа түсе алмайды. Мыстың мөлшерінің аз немесе көп екендігінің көрсеткіші — адамның шашы. Мыстың мөлшері төмендеген кезде немесе жетіспеген жағдайда шаш тез ағарады. Мыс қанға оттегінің өтуін қамтамасыз етеді. Мыс көптеген ферменттердің құрамына кіреді, ұлпалардағы тотығу реакциясын жылдамдатады.
Мыс ағзаға тағам арқылы түседі. Әсіресе, теңіз тағамдарында, қырыққабатта, картопта, қалақайда, жүгеріде, сәбізде, алмада көбірек кездеседі.
Мыс. Ересек адамның ағзасында 100 мг дейін мыс болады. Басқа металл иондарына қарағанда мыс иондары аминқышқылдарымен, ақсылдармен активті түрде әрекеттеседі, сондықтан мыс биологиялық активті заттармен тұрақты комплекстер түзеді. Ағзадағы мыстың негізгі функциясы каталиттік әсері, қазіргі таңда мыс элементі бар ферменттер (церулоплазмин, тирозиназа, цитохромоксидаза) белгілі. Медицинада мыс сульфаты СuSО4 • 5Н2О антисептикалық зат ретінде терінің күйген жеріне жағуға, көз тамшысы ретінде т.б. қолданылады.Мысқа қажеттілік қабыну жәнебуын дерттерінде артады.
Күміс (лат. Argentum, Ag) —элементтердің периодтық жүйесінің І тобындағы химиялық элемент, атомдық нөмірі 47, атомдық массасы 107,88. Табиғатта тұрақты екі изотопы бар: 107Ag және 109Ag. Элементтердің периодтық жүйесінің І тобындағы хим. элемент, ат. н. 47, ат. м. 107,88. Табиғатта тұрақты екі изотопы бар: 107Ag және 109Ag. Негізгі минералдары: аргентит Ag2S, пираргирит Ag3SbS3, прустит Ag3AsS3, саф К., т.б. К. жұмсақ, созылғыш (1 г К-тен ұзындығы 1800 м сым тартуға болады), ақ түсті металл, тығызд. 10,5 г/см3, балқу t 961,9°С, қайнау t 2170°С, тотығу дәрежелері +1, +2, +3, сиректеу +4. Электр тогын, жылуды жақсы өткізеді. К-тің активтігі нашар, коррозияға төзімді, бірақ күкірт, галогендермен тез әрекеттеседі. Қыздырылған концентрлі азот және күкірт қышқылдарында ериді. Ауадағы оттекпен жоғары температурада қыздырғанда да әрекеттеспейді, бірақ құрамында күкіртсутек бар дымқыл ауада оттек арқылы тез тотығып беті қараяды. К. қорғасын-мырышты, мыс, алтын-күмісті кентастардан алынады. Оның басқа металдармен қорытпасы зергерлік бұйымдар жасауда, медицинада К. препараттары (күйдіретін, микробтарды жоятын, т.б.), кино және фотоөнеркәсібінде, химия, электртех. және электрондық өнеркәсіптерінде, т.б. қолданылады. Аg+ иондары суды жақсы тазартады. Қазақстанда К. Бозшакөл, Қоңырат, Ақтоғай, Айдарлы, Бақыршық, т.б. кен орындарында кездеседі.
Күмістің биологиялық маңызы[ өңдеу ]
КҮМІС. Бактерицидтік және антисептикалық қасиетке ие. Әрі қабынуға да қарсы әрекет ете алады. Бір сөзбен айтсақ, табиғи бактерицидтік металл. Бактерияның 650 түріне қарсылық білдіре алады екен.
Қазақ халқы ежелден күмістің адам ағзасына пайдасы бар деп сеніп, күміс ыдыстан тамақ ішіп, күміс әшекейлер тағып, сәби дүниеге келгенде нәрестені күміс теңге салынған суда шомылдырып, «Баланың күні күмістей жарық болсын» деген жоралғы жасаған. Металдың өзінің әдемілігімен қатар, таңғажа-йып емдік қасиеті де жоқ емес. Күмістің емдік қасиеті медицинада дәлелденген.
Емшілер өте ерте заманда-ақ күмістің қасиетін ерекше бағалаған. Мысалы, Үндістанда, Египетте, Ресейде күміс қосылған суды түрлі ауруларға ем ретінде пайдаланған. Адамдар мұндай судың өмірлік қуат беретін ерекше сиқыры барлығына сенген.
Ғалымдар болса, күмістің бұл қасиетте-ріне ХІХ ғасырдың аяғында ғана мән беріп, зерттей бастапты. Күміс сумен әрекеттескенде иондалып, оның құрамында ұзақ сақталады. Сондықтан күміс қосылған су ағзадағы көптеген зиянды микроағзаларды жояды. Адам ағзасының тұмау және жұқпалы ауруларға төтеп бере алмауының себебі иммундық жүйедегі күмістің азаюынан болады. Күміс тек қана ауру тудыратын элементтерді жойып қоймай, ағзадан зиянды токсиндер мен микробтарды шығарады. Тіпті ағзада аз ғана күміс жетіспеушілігі байқалған жағдайда адамның жұмыс істеу қабілеті төмендеп, қорғаныш қасиеті азайып, тез шаршау пайда болады. Шетелдік дәрігер Роберт Бекер күміс иондарының адам ағзасындағы жасушалардың көбеюіне әсер ете алатындығын дәлелдеген. Ол өзінің ғылыми кітабында күміс иондарының қатерлі ісік ауруына шалдыққан адамдардың жасушаларын қайта тірілтіп, көбеюіне көмегі барлығын жазған.
Сірә, алтын-күміс қасықпен ас ішу тек қана байлықтың көрінісі ғана емес, салауаттылықтың да белгісі болса керек.
Күміс. Тірі ағзада күмістің физиологиялық рөлі жеткіліксіз зерттелген. Күміс – ультрамикроэлемент.
Медицинада қолданылуы:
1. АgNОз (ляпис) – күміс нитраты – жұмсартушы және күйдіруші зат ретінде қолданылады. Стоматологияда тісті бүтіндеу, алдын ала тіс каналдарын күмістейді. Бірінші күміс нитратынан күміс оксидінің аммиакты ерітіндісін және 10%-тік формалинді алады.
2. Қағаз, мақта, дәке бұлардың бәрі күмістің хлориді мен нитраты ерітіндісіне шыланған болады, олар бактерицидті байлайтын материал ретінде қолданылады.
Билет
1. Химиялық тепе-теңдік. Тепе-теңдік константасы. Ле-Шателье принципі
Химиялық тепе-теңдік — бір немесе бірнеше қарама-қарсы жүретін қайтымды реакциялар жылдамдықтарының теңескен күйі. Қайтымды реакция аяғына дейін жүрмейді, ол басталғанда тура жүретін реакцияның жылдамдығы (v1) жоғары, кері реакция жылдамдығы (v2) баяу болады. Тура реакция жүрген сайын реакцияға алынған заттың концентрациясы азайып, v1 — жылдамдығы кемиді, керісінше, тіке реакциядан пайда болған өнімнің концентрациясы артып, v2 күшейеді. Біртіндеп екі реакция жылдамдығы теңеседі: v1=v2. Осындай жағдайды химиялық тепе-теңдік деп атайды. Тепе-теңдік орнағанмен қарама-қарсы бағытталған екі реакция да тоқтамай жүре береді. Егер сыртқы жағдай (қысым, концентрация, температура) өзгермесе реакция жылдамдықтары тең болып, химиялық тепе-теңдік орнаған қалпында қала береді, сондықтан оны жылжымалы немесе [динамикалық] тепе-теңдік деп те атайды. Реакцияласушы жүйенің бір тепе-теңдік күйден басқа басқа тепе-теңдік күйге ауысуын химиялық тепе-теңдіктің ығысуы дейді. Химиялық тепе-теңдік орнаған кездегі реакцияға қатысқан әр заттың концентрациясы тепе-теңдік концентрациясы деп аталады. Химиялық тепе-теңдікті сан жағынан сипаттайтын көрсеткіш тепе-теңдік константасы (тұрақтысы) (К) деп аталады:
aA+bB=pP+qQ,
мұндағы бас әріптер — заттардың формулалары, кіші әріптер — реакциядағы молекула сандарын көрсететін коэффициенттер. Тепе-теңдік константасы тура және кері реакциялардың жылдамдық константаларының (k1,k2) қатынасы деп те аталады:
K=k1/k2.
К — белгілі температурада тура реакция өнімдері мен реакциясы алынған заттардың мольдік көбейтінділерінің қатынасын көрсететін тұрақты шама. Тепе-теңдік константасының теңдеуі реакцияға қатысқан заттардың тепе-теңдік концентрацияларының бір-біріне тәуелділігін көрсетеді.
Ле-Шателье принципі
Әрекеттесуші заттардың концентрациясы, температурасы және қысымы өзгергенде хим. тепе-теңдіктің ығысу бағыты жылжымалы тепе-теңдік принципі немесе Ле Шателье принципі деп аталатын жалпы ережемен анықталады: тепе-теңдік күйіндегі системаға сырттан әсер етсе(концентрация, температура, қысым өзгерсе) онда қарама-қарсы екі реакцияның ішінен сол әсерді азайтатынының жүруіне көмектеседі.
2. Жоғарымолекулалық қосылыстар және олардың ерітінділері. Жалпы қасиеттері. Полимерлердің ісінуі және еруі. ЖМҚ ерітінділерінің тұтқырлығы
Жоғары молекулалы қосылыстардың қатарына м.с. 1 0мың миллионлаған к.б. дейін жететін қосылыстар жатады. Бұған белок, нуклеин қышқылдары, крахиал, каучук, жасанды смола, капрон, полиэтилен, нейлон т.б. Бұл қосылыстра екі үлкен топқа бөлінеді.
1.Табиғи жоғары молекулалы қосылыстар, яғни биосинтез және фотосинтез нәтижесінде түзілеті биополимерлер(ақуыз, крахмал, полисахарид)
2. жасанды немесе снтетикалық ЖМҚ, яғн полимеризация және поликонденсация
ЖМҚ ерітінділері. ЖМҚ нағыз және коллоидтық ерітінділер түзе алады. ЖМҚ ерітінділері өздігінен түзіледі және термодинамикалық тұраұты болады. Мысалы, ақсылдар изоэлектрлік нүктеде де (ξ=0) тұрақты.
Ерітінді сипаты ЖМҚтың ерітікішке ынтықтылығына байланысты. ЖМҚ полярлығы еріткіш полярлығымен сәйкес болса, нағызғ яғни молекулалық ертіндіт түзіледі(мысалы, агар-агар не желатин суда, ал каучук бейполяр еріткіштерде). егер ЖМҚ мен еріткіш полярлықты сәйкес болмаса, онда зольдер пайда болады.
ЖМҚ ерітінділерінің тұрақтылығын жою үшін оларға сольватты қабатты үзетін заттар(электррлиттер) қосады. Еріткіш активтілігін төмендету үшін, мысалы, ақсылдың сулы ерітінісіне спирт, немесе каучуктың бензолдығы ерітіндісіне ацетон қосуға болады.
ЖМҚ-дың қасиеттері.
1) Мембрана арқылы өтпеуі;
2) Баяу диффузиялық жылдамдық;
3) Пептизация және коагуляция(электролиттердің қосылуы, температура)
Шын ерітінділермен ұқсастығы:
1) Гомогендәләгә яғни біртектілігі;
2) Тұрақтылығы;
3) ЖМҚ ерітндісі түзілуінің өз бетімен жүретіндігі;
4) Осы процестің қайтымдылығы.\
ЖМҚ ерітіндісінің ерекше қасиеттері:
1) Ісіну;
2) Тұтқырлығының жоғарылығы;
3) Кілегейлену;
4) Тұнбаға түсу;
5) Коацервация;
6) Денатурациялану;
Полимерлердің ісінуі және еруі. Полимерлердің еруі. Төмен молекулалық қосылыстар, мысалы, қант суда ерігенде екі компонент жанасқан кезде қант молекулалары су фазасына, ал су молекулалары қант фазасына енеді, яғни олардың молекулалық мөлшерлері бір – біріне жақын болғандықтан екі жақты диффузия жүреді.
Макромолекулалардың мөлшері еріткіш молекулаларының мөлшерінен мыңдаған есе үлкен. Сондықтан да олардың қозғалғыштығы өте аз. Полимер мен еріткіш молекулалары бір – біріне жанасқанда сұйықтың молекуласы полимер фазасының ішіне жылдам кіріп кетеді. Ал макромолекулалар бұл кезде еріткіштің фазасына еніп үлгермейді.
Поолимер еріген кезде негізінен еріткіш молекулалары полимерге бір жақты диффузияланады. Бұған біріншіден, еріткіш молекулаларының аса қозғалғыштығы себепші болса, екіншіден полимер макромолекулаларының текшелену тығыздығының босаңдау болуы ықпал етеді.
Макромолекулалардың арасынлда жылулық қозғалыстың әсерінен пайда болатын бос молекулааралық көлемге еріткіштің молекулалары сиып кете алады. Мұнда макромолекуланың есесіне келетін еріткіш әлі аз, яғни еріткіштің полимердегі ерітіндісі түзіледі. Еріткіш молекуласының бір жақты қозғалып, макромолекулалардың арасына енуінен полимер ісінеді. Бұл кезде полимердің көлемі әрдайым өседі, ал барлық жүйенің көлемі (полимер – еріткіш) әдетте азаяды. Ісінген кезде жүйе көлемінің азаюын концентрация деп атайды.
ЖМҚ ертінділерінің тұтқырлығы. Тұтқырлық не ішкі үйкеліс деп ортаның қарсылық жасау шамасын айтады.
Тұтқырлықты өлшеу- макромолекула қасиеттерін зерттеудің қарапайым және тиімді әдісі. Оның бағалығы; биополимерлердің солекулалық массасын М анықтауға мүмкіндік береді.
И. Ньютон сұйықтықтың ламинарлы қабат бойымен ағысы үшін мына байланысты анықтады:
F=ɳ  S
S
Мұндағы, F- сұйықтық қабаттарының өзара ығысуын туғызатын тангенциалды жанама күш; ɳ-динамикалық тұтқырлық коэфиценті;  - ағу жылдамдығының градиенті; S- ығысу өтетеін қабат ауданы. Аққыштық (ɸ) ɳ-ге қарсы шама.
- ағу жылдамдығының градиенті; S- ығысу өтетеін қабат ауданы. Аққыштық (ɸ) ɳ-ге қарсы шама.
Салыстырмалы тұтқырлық былай өрнектеледі:
ɳ= 
мұнда,ɳ- ерітіндінің және таза еріткіштің тұтқырлығы, ал t- сәйкес ағу уақыттары.
Меншікті тұтқырлық салыстырмалы тұтқырлықтың бір санына қатысты артуын көрсетедеі.
ЖМҚ ерітінділері тұрақтылығының бұзылуы. ЖМҚ тұздау ЖМҚ ерітіндііне бейэлектролит қосып, бөліп алу. ЖМҚ ісінуіне иондар әсерінің тиотроптық қатары тұздау эффектісі бойынша кері ретке ие. Ең төмен тұздау эффектісін жұмсақ негіздер- катиондар көрсетеді, олар әлсіз гидраттанады және полимер молеклаларында жақсы адсорбацияланды.
ЖМҚ ерітінділіерінің тұтқырлығы полимер лиофильдігі кемігенде төмендейді.
Лиофильдік ЖМҚ сулы ерітінііне полимер нашар еритін еріткішті қосқанда төмендейді, мысалы, этанол желатинді тұздайды.
Билет
1. Катализ және катализаторлар. Гомогенді катализ. Қышқылдық- негіздік катализ. Гетерогенді катализ. Ферментер биологиялық катализаторлар ретінде.
Химиялық реакция жылдамдығын катализатор көмегімен реттеуге болады. Катализатор деп, реакция жылдамдығын өзгертетін және реакция нәтижесінде өзгеріссіз қалатын заттарды айтады.
Егер катализатор реакция жылдамдығын арттыратын болса, оны оң, ал баяулататын болса т еріс катализатор деп атайды.
Егер катализатор реакция барысында түзілсе, оны автокатализ деп атайды. Кейбір заттар катализатордың әсер етуіне кедергі жасайды, ондай заттарды ингибиторлар немесе катализатор улары деп атайды.
Ал кейбір заттар өздері катализатор болмаса, катализатордың активтілігін арттырады, ондай заттарды активаторлар деп атайды. Реакцияға қатысатын заттардың және катализатордың агрегаттық күйіне байланысты каталитикалық реакциялар гомогендік және гетерогендік деп атайды. Реакцияға қатысатын заттар мен катализатор бірдей агрегаттық күйде болса, гомогендік катализ, ал әртүрлі агрегаттық күйде болса, гетерогендік катализ деп атайды.
Қышқылдық- негіздік катализ - қышқылдың реакцияға қатысатын заттың біріне өзінің протонын беруі арқылы жүретін катализдің түрі. Қышқылдық-негіздік Катализге каталитикалық крекинг, гидраттану, дегидраттану, органикалық заттардың конденсациялануы, изомерлену реакциялары, тағы басқа жатады. Мұндай Катализдің катализаторлары – реагенттерге протон беретін немесе олардан протон алатын реагенттер мен гетеролиттік әрекеттесетін заттар. Мысалы, протондық (H2SO4, HCl, CH3COOH) және апротондық қышқылдар (BF3, AlCl3, тағы басқа), алюмосиликаттар Al2O3, фосфаттар, сульфаттар, тағы басқа Кейде негіздік сипаттағы катализаторлар да қолданылады (еріген негіздер, қатты CaO, MgO, тағы басқа). Реагенттерді активтендірудің әр түрлі жаңа әдістері табылуына қарамастан қазіргі кезде хим. өндірістің 80 – 90%-і каталитикалық процестердің үлесіне тиеді. Өндірістік каталитикалық процестерге майларды гидрогенизациялау, бензолды циклогексанға түрлендіру, нитробензолды анилинге айналдыру; мұнай өңдеу процесінде мұнай көмірсутектерін крекингілеу, жоғары сапалы бензиндер, дизельдік және реактивтік отындар алу үшін каталитикалық риформинг, алкилдеу, гидрокрекингілеу және су арқылы тазалау жатады.
Ферменттер биологиялық катализаторлар ретінде
Тірі организмде маңызды роль атқаратын биокатализатор – ферменттердің зат алмасуға, тыныс алуға тканьдер мен клеткалардың құрамына қосатын үлесі. Тірі организмде жүретін барлық химиялық реакциялар ферменттердің қатысуымен жүреді. Ферменттер химиялық реакция жылдамдығын, химиялық қарапайым катализаторларға қарағанда миллион есе арттырады. 1 гр таза пепсин 50 кг жұмыртқа белогын ыдыратса, 1гр ренин 72 т сүтті іріте алады. Ферменттердің аса бір маңызды қасиеті – ерекше талғап алу қасиеті, яғни әрбір фермент адам организмнде жүретін белгілі бір реакцияға ғана қатысып, соның жылдамдығын арттырады. Адам организмінде 1000-нан аса фермент бір мезгілде мыңдаған реакцияға қатысып, организмде жүретін реакциялар жылдамдығын өзгерте алады.
2. Коллигативті қасиеттер. Қату температурасының төмендеуі. Эббулоскопия.
Коллигативті қасиеттері дегеніміз салыстырмалы сипаттамалыр еріген затты
 2018-01-21
2018-01-21 1820
1820






