6. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Это объясняют тем, что электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке (например, у фтора по сравнению с кислородом) не приводит к увеличению размеров атома. Наоборот, размеры атома фтора меньше, чем атома кислорода (рис. 4-8).
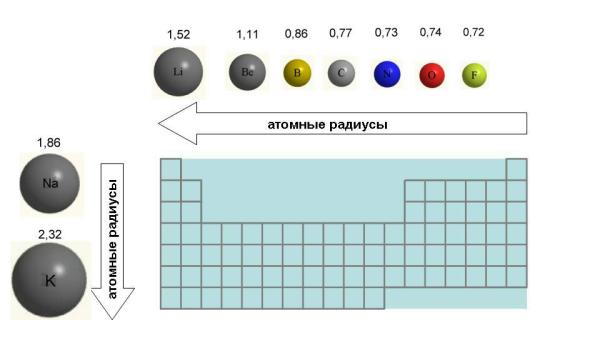
Рис. 4-8. Изменение атомных радиусов на примере элементов 2-го периода и 1-й группы Периодической таблицы. Атомные радиусы даны в ангстремах (1 А = 10-8 см).
7. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
 2018-01-21
2018-01-21 513
513






