В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны приниматьэлектронные пары. Это, например, ионы водорода — протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот.
Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода,спирты, галогены.
Примеры химических реакций между кислотами и основаниями Льюиса:
· AlCl3 + Cl− → AlCl4−
· BF3 + F− → BF4−
· PCl5 + Cl− → PCl6−.
35.растворение- как физико химический процесс. Теория электролитической диссоциации. Слабые и сильные электролиты.
Классическая теория электролитической диссоциации
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс. Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа:

Константа диссоциации  определяется активностями катионов
определяется активностями катионов  , анионов
, анионов 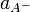 и недиссоциированных молекул
и недиссоциированных молекул  следующим образом:
следующим образом:

Слабые электролиты
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Слабыми электролитами являются: почти все органические кислоты и вода; некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H3PO4,H2CO3, H2SiO3, H2SO3 и др.; некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.
Сильные электролиты
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
 2018-01-21
2018-01-21 1960
1960







