При взаимодействии атомов, значение
электроотрецательностей которых отличаются, но не резко, происходит смещение
общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается
как в неорганических, так и органических соединениях.
К ковалентным связям в полной мере относятся и те связи, которые образованы по
донорно-акцепторному механизму, например в ионах гидроксония и амония.
Металлическая связь.
Связь, которая образуется в результате взаимодействия относите-льно свободных электронов с
ионами металлов, называются металлической связью. Этот тип связи характерен
для простых веществ- металлов.
Сущность процесса образования металлической связи состоит в следующем: атомы
металлов легко отдают валентные электроны и превращаются в положительные
заряженные ионы. Относительно свобо-дные электроны, оторвавшиеся от атома,
перемещаются между положи-тельными ионами металлов. Между ними возникает
металлическая связь, т. е. Электроны как бы цементируют положительные ионы
кристал-лической решетки металлов.
Водородная связь.
Связь, которая образуется между атомов
водорода одной молекулы и атомом сильно электроотрицательного элемента (O,
N, F) другой молекулы, называется водородной связью.
Может возникнуть вопрос: почему именно водород образует такую специфическую
химическую связь?
Это объясняется тем, что атомный радиус водорода очень мал. Кроме того, при
смещении или полной отдаче своего единственного электрона водород приобретает
сравнительно высокий положительный заряд, за счет которого водород одной
молекулы взаимодействует с атомами электроотрицательных элементов, имеющих
частичный отрицательный заряд, выходящий в состав других молекул (HF, H2O, NH3).
Рассмотрим некоторые
примеры. Обычно мы изображаем состав воды химической формулой H2O. Однако это не совсем точно. Правильнее было бы состав воды обозначать
формулой (H2O)n, где n = 2,3,4 и т. д. Это
объясняется тем, что отдельные молекулы воды связаны между собой посредством
водородных связей.
Водородную связь принято
обозначать точками. Она гораздо более слабая, чем ионная или ковалентная связь,
но более сильная, чем обычное межмолекулярное взаимодействие.
Наличие водородных связей объясняет
увеличения объема воды при понижении температуры. Это связано с тем, что при
понижении температуры происходит укрепление молекул и поэтому уменьшается
плотность их «упаковки».
При изучении органической
химии возникал и такой вопрос: почему температуры кипения спиртов гораздо выше,
чем соответствующих углеводородов? Объясняется это тем, что между молекулами
спиртов тоже образуются водородные связи.
Повышение температуры кипения
спиртов происходит также всле-дствие укрупнения их молекул.
Водородная связь характерна и для многих других органических соединений (фенолов,
карбоновых кислот и др.). Из курсов органической химии и общей биологии вам
известно, что наличием водородной связи объясняется вторичная структура белков,
строение двойной спирали ДНК, т. е. явление комплиментарности.
Виды химической связи ковалентная ионная металическая водородная характерные свойства. Виды химической связи и формы перекрывания электронных облаков в органической химии. Генетическая связь между классами органических и неорганических веществ. Наиболее распространенный вид химической связи в органических веществах. Наиболее распростаненный вид химической связи в органических веществах. Основные виды химических связей в неорганической и органической химии. Типы химической связи в органических соединениях характеристики связи. Виды химической связи в неорганических и органических соединениях. Какой вид химической связи характерен для органических соединений. Ковалентная связь как наиболее характерна органических соединений. Виды химической связи в неоргонических и оргонических соединениях. Генетическая связь между основными классами органических веществ. Какой вид связи наиболее характерен для органических веществ. Тип химической связи органических и неорганических веществ. ОСНОВНЫЕ ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ.
Существуют два главных способа образования ковалентной связи *.
1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных атомах.
Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень:
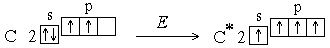
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентность атома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомов азота, кислорода, фтора количество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободных орбиталей *, а перемещение электронов на третий квантовый уровень требует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободные орбитали возможны только в пределах одного энергетического уровня.
Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня:
P* 1s22s22p63s13p33d1 (валентность 5)
S* 1s22s22p63s13p33d2 (валентность 6)
Cl* 1s22s22p63s13p33d3 (валентность 7)
В приведенных выше электронных формулах * возбужденных атомов подчеркнуты подуровни *, содержащие только неспаренные электроны. На примере атома хлора легко показать, что валентность может быть переменной:
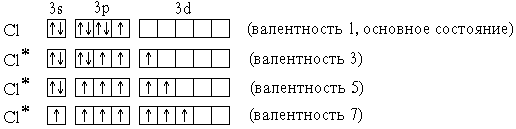
В отличие от хлора, валентность атома F постоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуют орбитали d-подуровня и другие вакантные орбитали.
2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиака и иона водорода можно отобразить схемой:
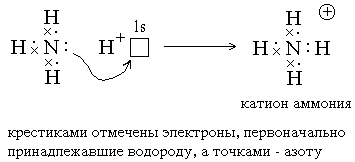
Атом, предоставляющий свою электронную пару для образования ковалентной связи *, называется донором, а атом, предоставляющий пустую орбиталь, – акцептором. Ковалентная связь, образованная таким способом, называется донорно-акцепторной связью. В катионе аммония эта связь по своим свойствам абсолютно идентична трем другим ковалентным связям, образованным первым способом, поэтому термин “донорно-акцепторная” обозначает не какой-то особый вид связи, а лишь способ ее образования.
5) Валентность углерода, входящие в состав органических соединений, всегда будут четырёхвалентны, имеют электронную конфигурацию 1s2s22p2 и могут находиться в трех валентных состояниях
Первое валентное состояние (на примере метана СН4). При образовании молекулы метана атом углерода переходит в возбужденное состояние:
Четыре неспаренных электрона (2s и 2р) участвуют в образовании четырех б - связей. При этом возникают гибридные орбитали. Гибридизация орбиталей - процесс выравнивания их по форме и энергии. Число гибридных орбиталей равно числу исходных орбиталей. В молекуле метана и во всех молекулах органических веществ по месту одинарной связи атомы углерода будут находиться в состоянии sр3 - гибридизации, т.е. у атома углерода гибридизации подверглись орбитали одного s - и трех р - электронов и образовались 4 одинаковые гибридные орбитали.
sp3 – гибридные облака располагаются под углом 109°28`.
Второе валентное состояние атома углерода на примере этилена (C2H4) В молекуле этилена каждый атом углерода соеденён с тремя другими атомами, поэтому в гибридизацию вступают З орбитали: одна s и две р, т.е. происходит sр2 - гибридизация.
Эти орбитали располагаются под углом 120° по отношению друг к другу.
Две негибридные орбитали перекрываются перпендикулярно плоскости и образуют – связь.
Третье валентное состояние атома углерода (на примере ацетилена С2Н2). В молекуле ацетилена атом углерода соединен с двумя другими атомами, поэтому в гибридизацию вступают две орбитали: одна s и одна p, т.е. происходит sp-гибридизация.
Эти орбитали располагаются под углом 180º по отношению друг к другу.Не вступившие в гибридизацию две p-отбитали при боковом перекрывании образуют две π-связи, расположенные во взаимно перпендикулярных плоскостях.
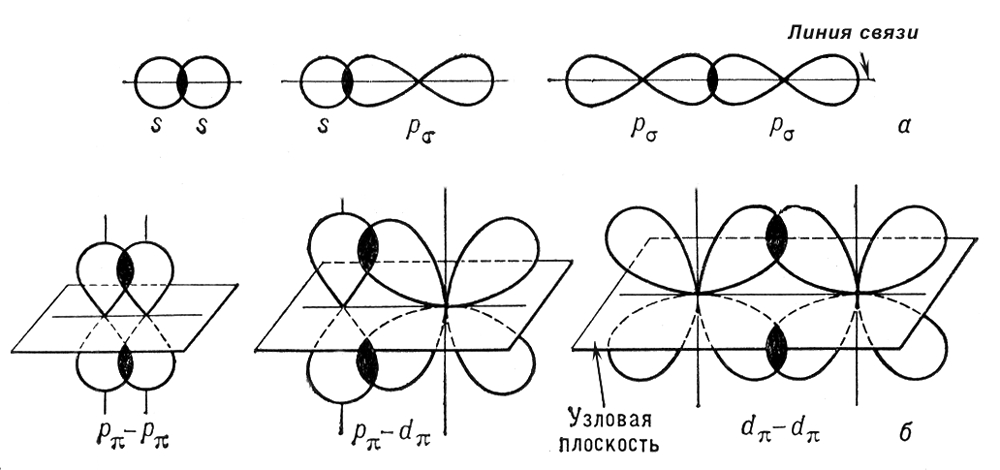
Сигма- и пи-связи (s- и p-связи), ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов взаимодействующих атомов. Результирующее электронное облако s-связи симметрично относительно линии связи, т. е. линии, соединяющей ядра взаимодействующих атомов. Простые связи в химических соединениях обычно являются (т-связями (см. Простая связь). Электронное облако p-связи симметрично относительно плоскости, проходящей через линию связи (рис. 1, б), причём в этой плоскости (называемой узловой) электронная плотность равна нулю. Употребление греческих букв s и p связано с соответствием их латинским буквам s и р в обозначении электронов атома, при участии которых впервые появляется возможность для образования s- и p-связей соответственно. Поскольку облака атомных р-орбиталей (px, ру, pz) симметричны относительно соответствующих осей декартовых координат (х, у, z), то, если одна р-орбиталь, например pz, принимает участие в образовании s-связи (ось z — линия связи), две оставшиеся р-орбитали (px, py) могут принять участие в образовании двух p-связей (их узловые плоскости будут yz и xz соответственно; см. рис. 2). В образовании s и p-связей могут принять участие также d- (см. рис. 1) и f-электроны атома.
Если между атомами в молекуле возникают одновременно как s-, так и p-связи, то результирующая связь является кратной
6) МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ, взаимод. молекул между собой, не приводящее к разрыву или образованию новых хим. связей. Межмолекулярное взаимодействие определяет отличие реальных газов от идеальных, существование жидкостей и мол. кристаллов. От межмолекулярного взаимодействия зависят мн. структурные, спектральные, термодинамич., теплофиз. и др. св-ва в-в. Появление понятия межмолекулярного взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, к-рый для объяснения св-в реальных газов и жидкостей предложил в 1873 ур-ние состояния, учитывающее межмолекулярное взаимодействие (см. Ван-дер-Ваальса уравнение). Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми.
 2018-01-21
2018-01-21 1148
1148