закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. Эквивалент(Э) – это реальная или условная частица вещества, которая может замещать, присоединять или выделять один ион водорода в кислотно-основных или ионообменных реакциях или один электрон в окислительно-восстановительных реакциях. Под «реальной частицей» понимают реально существующие соединения (КОН, H2SO4, Н2О), под «условной» – доли этих реальных частиц (1/2H2SO4, 1/5KMnO4). Эквивалент так же, как атом, молекула, ион – безразмерная величина, и его состав выражают с помощью химических формул и символов. Количество вещества эквивалентов измеряется в молях. Масса 1 моля эквивалентов называется молярной массой эквивалентов (Мэ) и выражается в г/моль.
Молярная масса эквивалентов вещества, участвующего в окислительно-восстановительной реакции, рассчитывается так:
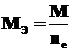 ,
,
где М – молярная масса вещества; nе– число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
|
|
|
Молярная масса эквивалентов кислоты или основания, участвующихв кислотно-основной реакции, рассчитывается по формуле
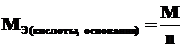 ,
,
где n – число функциональных групп: для кислот – число атомов водорода, замещенных в данной реакции на металл; для оснований – число гидроксильных групп, замещенных в данной реакции на кислотный остаток.
Молярная масса эквивалентов соли в реакциях обмена рассчитывается по формуле:
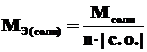 ,
,
где n – число ионов металла, участвующих в реакции от каждой молекулы; |c.o.| – абсолютное значение степени окисления иона металла.
Молярная масса эквивалентов оксида рассчитывается по формуле:
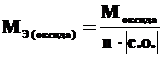 ,
,
где n – число катионов соответствующего оксиду основания или число анионов соответствующей оксиду кислоты; |c.o.| – абсолютное значение степени окисления катиона или аниона.
Чтобы определить молярную массу эквивалентов элемента в соединении, можно воспользоваться формулой
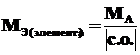 ,
,
где МА – молярная масса атома элемента; |c.o.| – абсолютное значение степени окисления элемента.
В общем виде закон эквивалентов формулируется следующим образом: массы реагирующих друг с другом веществ прямо пропорциональны молярным массам их эквивалентов:
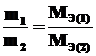 .
.
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl2 (средняя соль):
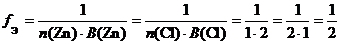 .
.
f Э(ZnCl2) = 1/2, поэтому эквивалентом ZnCl2 является частица 1/2ZnCl2.
б) КНСО3 (кислая соль):
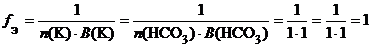 .
.
f Э(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4 (основная соль):
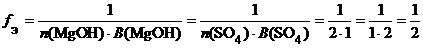 .
.
f Э((MgOH)2SO4) = 1/2, поэтому эквивалентом (MgOH)2SO4 является частица 1/2(MgOH)2SO4.
|
|
|
 2018-01-21
2018-01-21 700
700








