К этому типу относят коррозию металлов, происходящую в растворах или расплавах электролитов. В отличие от химической, электрохимическая коррозия обусловлена появлением местных электрических токов. В этом случае наряду с химическими процессами (отдача электронов) протекают и электрические (перенос электронов от одного участка к другому). Другое важное отличие электрохимической коррозии от химической состоит в том, что общая реакция взаимодействия металла с окислителем может быть разделена на два процесса: анодный и катодный. Эти два сопряженных процесса взаимосвязаны и не могут протекать один без другого, например коррозия стали:
 Анодный процесс в данном случае заключается в окислении металла – переходе ионов металла из кристаллической решетки в раствор в виде гидратированных ионов. Если бы никаких других электродных процессов в системе не происходило, то анодный процесс вскоре прекратился из-за наступления равновесия:
Анодный процесс в данном случае заключается в окислении металла – переходе ионов металла из кристаллической решетки в раствор в виде гидратированных ионов. Если бы никаких других электродных процессов в системе не происходило, то анодный процесс вскоре прекратился из-за наступления равновесия: 
Катодный процесс заключается в восстановлении окислителей – химическом связывании избыточных электронов молекулами, атомами или ионами окислителей, присутствующими в окружающей среде. Молекулы, атомы или ионы веществ, которые связывают электроны, называют деполяризаторами коррозии.
Наиболее часто встречающиеся катодные процессы:
1. Восстановление ионов водорода (деполяризатор – ион водорода): а) 2H+ + 2e = 2H; 2H = H2 (pH < 7); б) 2H2O + 2e = H2 + 2OH-; 2H = H2 (pH ³ 7) В этом случае коррозионный процесс называется коррозией с выделением водорода, или коррозией с водородной деполяризацией.
2. Ионизация молекул кислорода (деполяризатор – молекула кислорода):
а) O2 + 4H+ + 4e = 2H2O (pH < 7);
б) O2 + 2H2O + 4e = 4OH- (pH ³ 7)
При коррозии в атмосферных условиях на катодных участках имеет место борьба за преимущественное связывание электронов между ионами водорода (воды или кислоты) и молекулами кислорода, растворенного в жидкости. Вопрос решается в зависимости от величин электродных потенциалов металлов и потенциалов водородного и кислородного электродов в данных условиях.
Если потенциал металла–анода более отрицателен, чем потенциалы водородного и кислородного электродов в данных условиях, то коррозия может происходить как с ионизацией кислорода, так и с выделением водорода, т. е. оба катодных процесса будут протекать одновременно, параллельно. Если же потенциал металла более положителен, чем потенциал выделения водорода, но более отрицателен, чем потенциал ионизации кислорода в данных условиях, то коррозия металла может происходить только с поглощением кислорода.
Коррозия, возникающая при контакте двух металлов различной активности (гальванокоррозия). Определение катодного и анодного участков. Процессы, протекающие на катодном и анодном участках.
Частным случаем электрохимической коррозии является гальванокоррозия.
Гальванокоррозия возникает при контакте двух металлов различной активности. При этом металл с меньшим значением электродного потенциала начнет окисляться, т. е. выполнять функцию анода под действием окислителя, который будет восстанавливаться на поверхности другого металла, играющего роль катода. Образуется гальваническая пара.
Окисление металла, являющегося анодом самопроизвольно возникающей гальванической цепи, и называется гальванокоррозией.
Процессы, протекающие при гальванокоррозии, можно рассмотреть на примере действия воды на два металла, находящиеся в контакте железо – медь:
По табличным данным (рН = 7):
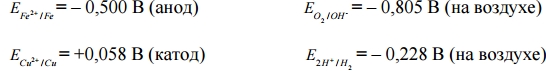


 2018-01-21
2018-01-21 2514
2514
