В первую очередь на состояние строительных материалов негативно влияет агрессивная окружающая среда.
Вода, углекислый газ, соли, перепады температур очень часто вызывают коррозию. В связи с этим важнейшей проблемой и задачей номер один при строительстве и последующей эксплуатации любых объектов является защита от коррозии бетона.
Причины коррозии
Структура произведенного на минеральной основе бетона — каппилярно-пористая. Поэтому он очень сильно подвержен негативному воздействию.
Атмосферные явления в пористой структуре бетона образуют кристаллы. Затем они увеличиваются и вызывают трещины.
Хлориды, сульфаты и карбонаты, растворенные в воздухе в большом количестве, тоже разрушительно влияют на строительные конструкции.
Коррозия бетона и ее виды
Коррозия бетона бывает трех видов. Основным критерием для классификации является степень ухудшения его свойств и характеристик.
— коррозия 1 степени — вымываются составные части бетона;
— коррозия 2 степени — образуются продукты коррозии без вяжущих свойств;
— коррозия 3 степени — накапливаются малорастворимые кристаллизующиеся соли, которые увеличивают объем.
Методы защиты бетона
Для защиты бетона от коррозии, а также повышения его долговечности необходимо применять первичную и вторичную его защиту.
Первичная защита подразумевает введение самых разных модифицирующих добавок. Это могут быть стабилизирующие (предупреждают расслоение), пластифицирующие (увеличивают), водоудерживающие и регулирующие процесс схватывания бетонной смеси, ее пористость, плотность и т.д.
Методы вторичной защиты от коррозии бетона подразумевает нанесение защитных покрытий:
— лакокрасочные мастичные покрытия. Они используются при воздействии жидких сред, и непосредственном контакте бетона с агрессивной твердой средой.
— лакокрасочные и акриловые покрытия. Эти средства образуют прочную атмосферостойкую и долговечную защиту. К примеру, акрил создает полимерную пленку, предотвращая тем самым коррозию бетона. Более того, он защищает поверхность от микроорганизмов и грибков.
— уплотняющие пропитки. Эти вещества придают бетону гидрофобные свойства. Они очень резко повышают водонепроницаемость, а также снижают водопоглощение материалов. Применяются в условиях повышенной влажности и в местах, требующих специальные санитарно-гигиенические мероприятия.
— оклеечные покрытия. Их применяют при воздействии жидких сред (например, если имеет место подтопление бетонной сваи подземными водами). Кроме того, их используют в качестве непроницаемого подслоя для облицовочных покрытий. К примеру, полиизобутиленовые пластины, полиэтиленовая плёнка, рулоны нефтебитума и т. п.
— биоцидные материалы. Они призваны уничтожать и подавлять на бетонных конструкциях грибковые образования. Химически активные элементы проникают в структуру бетона и заполняют микротрещины и поры.
Антикоррозийные покрытия для бетона применяются всюду: в стенах и полах жилых помещений, в гаражных комплексах, фундаменте, коллекторах, очистных сооружениях, теплицах, оранжереях.
Билет№ 19
1) из 400г 50%-ного (по массе) раствора H2SO4 выпариванием удалили 100г воды. чему равна массовая доля H2SO4 в оставшемся растворе??
Масса серной кислоты в растворе
m(H2SO4) = m1(р-ра H2SO4) * W1 / 100 = 400 * 50 / 100 = 200 г.
Масса полученного раствора
m2(р-ра H2SO4) = m1(р-ра H2SO4) - m(H2O) = 400 - 100 = 300 г.
Концентрация серной кислоты в полученном растворе:
W2 = m(H2SO4) * 100 / m2(р-ра H2SO4) = 200 * 100 / 300 = 66,67 %
2) Элементы, проявляющие в соединениях металлические и неметаллические свойства, называют амфотерными, к ним относятся элементы А-групп Периодической системы - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., а также большинство элементов Б-групп - Cr, Mn, Fe, Zn, Cd, Au и др. Амфотерные оксиды называют так же, как и основные, например:
BeO - оксид бериллия
FeO - оксид железа(II)
Al2O3 - оксид алюминия
Fe2O3 - оксид железа(III)
SnO - оксид олова(II)
MnO2 - оксид марганца(IV)
SnO2 - диоксид олова(IV)
ZnO - оксид цинка(II)
Амфотерные гидроксиды (если степень окисления элемента превышает + II) могут находиться в орто - или (и) мета - форме. Приведем примеры амфотерных гидроксидов:
Be(OH)2
- гидроксид бериллия
Al(OH)3
- гидроксид алюминия
AlO(OH)
- метагидроксид алюминия
TiO(OH)2
- дигидроксид-оксид титана
Fe(OH)2
- гидроксид железа(II)
FeO(OH)
- метагидроксид железа
Амфотерным оксидам не всегда соответствуют амфотерные гидроксиды, поскольку при попытке получения последних образуются гидратированные оксиды, например:
SnO2. nH2O
- полигидрат оксида олова(IV)
Au2O3. nH2O
- полигидрат оксида золота(I)
Au2O3. nH2O
- полигидрат оксида золота(III)
Если амфотерному элементу в соединениях отвечает несколько степеней окисления, то амфотерность соответствующих оксидов и гидроксидов (а следовательно, и амфотерность самого элемента) будет выражена по-разному. Для низких степеней окисления у гидроксидов и оксидов наблюдается преобладание основных свойств, а у самого элемента - металлических свойств, поэтому он почти всегда входит в состав катионов. Для высоких степеней окисления, напротив, у гидроксидов и оксидов наблюдается преобладание кислотных свойств, а у самого элемента - неметаллических свойств, поэтому он почти всегда входит в состав анионов. Так, у оксида и гидроксида марганца(II) доминируют основные свойства, а сам марганец входит в состав катионов типа [Mn(H2O)6]2+, тогда как у оксида и гидроксида марганца(VII) доминируют кислотные свойства, а сам марганец входит в состав аниона типа MnO4-. Амфотерным гидроксидам с большим преобладанием кислотных свойств приписывают формулы и названия по образцу кислотных гидроксидов, например НMnVIIO4 - марганцовая кислота.
Таким образом, деление элементов на металлы и неметаллы - условное; между элементами (Na, K, Ca, Ba и др.) с чисто металлическими и элементами (F, O, N, Cl, S, C и др.) с чисто неметаллическими свойствами существует большая группа элементов с амфотерными свойствами
3) Напишите выражение для константы равновесия гетерогенной системы CO2+C↔ 2CO. Как изменится скорость прямой реакции-образования CO,если концентрацию CO2 УМЕНЬШИТЬ В 4 РАЗА?
K = [CO]2 / [CO2] - выражение для константы равновесия.
Пусть было x моль/л CO2, тогда после уменьшения концентрации в 4 раза будет x/4 моль/л.
Скорость прямой реакции (до):
v = k*[CO2] = k*[x]
Скорость прямой реакции (после):
v' = k*[CO2]' = k*[x/4]
n = v'/v = (k*[x/4]) / (k*[x]) = 1/4 - скорость уменьшится в 4 раза.
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов, т.е. влево.
4) Стандартный водоро́дныйэлектро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную вводный раствор, содержащий ионы водорода. Потенциал пластины зависит[ уточнить ] от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант
Устройство
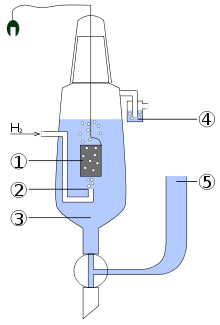

Схема стандартного водородного электрода:
1. Платиновый электрод.
2. Подводимый газообразный водород.
3. Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
4. Водяной затвор, препятствующий попаданию кислорода воздуха.
5. Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Из истории
 2018-01-21
2018-01-21 1323
1323
