Ответ. 537,5 г.
Ответ следует начать с характеристики положения неметаллов в периодической системе: если провести воображаемую диагональ от бериллия Be к астату At, то неметаллы расположатся в главных подгруппах выше диагонали (т. е. в верхнем правом углу). К неметаллам относятся также водород Н и инертные газы.
Далее важно отметить, что для общей характеристики неметаллов необходимо обратить внимание на строение их атомов, на то, как распределяются электроны по электронным слоям и сколько электронов приходится на внешний электронный слой. Можно привести строение атомов углерода С, азота N, кислорода О, фтора F. Это позволит сделать вывод о том, что по мере увеличения порядковых номеров атомов элементов и накопления электронов на внешнем слое у неметаллов одного периода усиливается способность принимать электроны от других атомов на свой внешний слой, т. е. неметаллические свойства элементов в периодах увеличиваются.
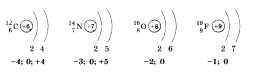
Рассматривая изменение свойств неметаллов при движении по группе, следует отметить, что они ослабевают. Это связано с увеличением расстояния от ядра до внешнего слоя, а следовательно, уменьшением способности ядра притягивать к себе электроны от других атомов. Для подтверждения этого вывода рассмотрим VI группу. В начале ее расположен кислород О — типичный неметалл, а заканчивается группа полонием Ро, обладающим свойствами металла.
Далее следует перейти к рассмотрению физических свойств неметаллов. Следует отметить, что простые вещества — неметаллы могут иметь как атомное (Si, В), так и молекулярное (Н2, N2, Br2) строение. Поэтому среди неметаллов есть газы (О2, С12), жидкости (Вг2), твердые вещества (С, 12). Большинство неметаллов не электропроводны, имеют низкую теплопроводность, а твердые вещества непластичны.
Переходя к характеристике химических свойств, необходимо отметить, что более типичным для неметаллов является процесс принятия электронов. В этом отличие химических свойств неметаллов от химических свойств металлов. Это положение можно подтвердить взаимодействием неметаллов с простыми веществами. При этом следует записать уравнения соответствующих химических реакций и объяснить их сущность с точки зрения процессов окисления — восстановления. Следует отметить, что неметаллы могут проявлять свойства как окислителей, так и восстановителей. Приведем примеры.

Можно добавить, что некоторые неметаллы могут реагировать и со сложными веществами (оксидами, кислотами, солями). Следующие уравнения учащийся приводит по желанию:

3) Константа равновесия гомогенной системы:
СО(г) + Н2О(г)  СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: ССО= 3моль/л, Сн2о= 2моль/л.
СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: ССО= 3моль/л, Сн2о= 2моль/л.
Решение
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:

В условии задачи даны исходные концентрации, тогда как в выражение Кс входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [CO2]=х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ:
[CO2] = [H2]= х моль/л; [CO] = (3 – х) моль/л; [H2O] = (2 – х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:

Таким образом, искомые равновесные концентрации: [CO2] =1,2 моль/л; [H2] =1,2 моль/л; [CO] =3 – 1,2 =1,8 моль/л; [H2O] =2 – 1,2 = 0,8 моль/л.
4)
Cu + 2 H2SO4 (КОНЦ) =CuSO4 + SO2 +H2O(оксл-восс реакция)
Cu+H2SO4(разб)= ничего не получится,Cu стоит правее от H-водорода,не будет вытеснять металл
5) ГИПСОВЫЕ ВЯЖУЩИЕ ВЕЩЕСТВА
Гипсовые вяжущие вещества делятся на две группы — низкообжиговые и высокообжиговые. Низкбобжиговые вяжущие вещества получают при нагреве двуводного гипса CaSO4-2H2O до температуры 150— 160° С; при этом происходит частичная дегидратация двуводного гипса с переходом его в полуводный гипс CaSO4 • 0,5 Н2О.
Высокообжиговые (ангидритовые) вяжущие получают обжигом двуводного гипса при более высокой температуре — до 700—900° С — с полной потерей химически связанной воды и образованием безводного сульфата кальция — ангидрита CaSO4. К низкообжиговым относится строительный и высокопрочный гипс, а к высокообжиговым — ангидритовый цемент и высокообжиговый гипс (эстрих-гипс).
Сырьем для производства гипсовых вяжущих являются природный гипсовый камень CaSC>4-2H2O и природный ангидрит CaSO4, а также отходы химической промышленности, содержащие двуводный или безводный сернокислый кальций, например фосфогипс.
Строительный гипс
Строительным гипсом называется воздушное вяжущее вещество, состоящее преимущественно из полуводного гипса и получаемое путем термической обработки гипсового камня при температуре 150—160° С. При этом CaSOi>2Н2О, содержащийся в гипсовом камне, дегидратируется по реакции:
CaSO4 • 2Н2О -»- CaSOi • 0,5Н2О + 1,5Н2О — q.
Производство строительного гипса складывается из дробления, помола и тепловой обработки (дегидратации) гипсового камня
Имеется несколько технологических схем производства строительного гипса; по одним — предварительная сушка и помол сырья в порошок предшествует обжигу, по другим — помол производится после обжига, а по третьим помол и обжиг совмещаются в одном аппарате. Последний способ получил название обжига во взвешенном состоянии.
Тепловую обработку гипсового камня можно осуществлять в варочных котлах, сушильных барабанах, шахтных или других мельницах. Выбор того или иного обжигательного аппарата зависит от масштабов производства, сырья, требуемого качества готовой продукции и ряда других факторов. Наиболее распространена технологическая схема с применением варочных котлов (31).
Гипсовый камень, поступающий на завод в крупных кусках, сначала дробят в щековых, конусных или молотковых дробилках, затем с одновременным подсушиванием измельчают в мельнице. Процесс сушки и помола целесообразно совмещать в одном аппарате, например в шахтной, аэродробильной или шаровой мельнице. Наибольшее распространение получила шахтная мельница (32), состоящая из молотковой мельницы и расположенной над ней шахтой высотой 12—15 м. В нижней части шахты имеются каналы, подающие теплоноситель (горючие газы) с температурой 300—500° С из топок варочных котлов. Молотковая мельница размещена несколько ниже. Гипсовый камень в виде щебня размером 3—4 см подается в мельницу тарельчатым питателем через течку в верхней части камеры, встречает на своем пути быстро вращающиеся била мельницы и измельчается в тонкий порошок. В мельнице из гипса удаляется и некоторая часть кристаллизационной воды.
Билет №18
1) V = 5 л = 5000 мл
m = ρ * V = 1.24 * 5000 = 6200 г
m(KOH) = ω * m / 100 = 26 * 6200 / 100 = 1612 г
n(KOH) = m(KOH) / M(KOH) = 1612 / 56 = 28.79 моль
2) основные свойства гидроксидов усиливаются по мере увеличения электроположительного характера образующих их элементов. Наиболее сильными основаниями являются гидроксиды наиболее электроположительных элементов, то есть элементов A подгрупп I и II групп периодической системы (также I и III аналитических групп). Электроположительный характер в пределах одной группы усиливается с увеличением радиусов ионов. Таким образом, гидроксиды, образованные элементами с законченным 2- и 8-электронным внешним слоем (I, III гр.), обладают основным характером более сильным, чем гидроксиды, образованные катионами такого же заряда, но с законченным 18-электронным внешним слоем. Поэтому с увеличением номера группы основный характер заметно ослабевает и переходит в амфотерный, а затем и в кислотный. Кислотный характер возрастает по мере увеличения электроотрицательности элемента.
3) А) NaOH+HCl -> NaCl+H2O-молекулярное уравнение
Na+OH+H+Cl -> Na+Cl+H2O-ионное уравнение
Na и Cl остались такими же, какими они были до реакции, т.н. они не приняли в нём участие. И их можно убрать и из правой, и из левой частей уравнения. Тогда получается?
OH+H -> H2O
Б) Na2S + Pb(NO3)2=>2Na(NO3) + PbS
полное ионное
2Na(+) + S(2-) + Pb(2+) + 2NO3(-) =>2Nа(+) +2NO3(-) + PbS
краткое ионное
S(2-) + Pb(2+) =>PbS
В)К2SO4 + H20 + CO2↑ - молекулярное
2K(+) + CO3(2-) + 2H(+) + SO4(2-) = 2K(+) + SO4(2-) + H2O + CO2↑ - полное ионное
CO3(2-) + 2H(+) = H2O + CO2↑ - сокращенное ионное
4) Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
а) Цинк более активный металл чем медь, поэтому он способен замещать медь в ее солях: Zn + СuSO4 → Cu + ZnSO4 Zn - 2e → Zn2+ Cu2+ + 2e → Cu Из уравнения реакции видно, что когда растворится 1 моль цинка (или 65 г), то на пластину осядет 1 моль меди (или 64 г). В итоге масса пластины незначительно уменьшится.
б) Цинк менее активный металл чем магний, поэтому он не способен замещать магний в его солях: Zn + MgSO4 ↛ реакция не идет Масса пластинки не изменяется.
в) Цинк более активный металл чем свинец, поэтому он способен замещать свинец в его солях: Zn + Pb(NO3)2 → Pb + Zn(NO3)2 Zn - 2e → Zn2+ Pb2+ + 2e → Pb Из уравнения реакции видно, что когда растворится 1 моль цинка (или 65 г), то на пластину осядет 1 моль свинца (или 207 г). В итоге масса пластины увеличится.
5) Коррозия бетона — это злейший враг минеральных строительных конструкций и материалов (газобетонные, пенобетонные и силикатные, блоки, асбоцемент, кирпич, железобетон, бетон).
 2018-01-21
2018-01-21 1654
1654