Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть содержится в скелете и зубах в виде фосфатов. Из различных форм карбоната кальция (извести) состоят скелеты большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также в обеспечении постоянного осмотического давления крови. Ионы кальция также служат одним из универсальных вторичных посредников и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов и др. Концентрация кальция в цитоплазме клеток человека составляет около 10−7 моль, в межклеточных жидкостях около 10−3 моль. Усваиванию кальция препятствуют аспирин, щавелевая кислота, производные эстрогенов. Соединияясь с щавелевой кислотой, кальций дает нерастворимые в воде соединения, которые являются компонентами камней в почках.
№ 26
Бор — элемент тринадцатой группы (по устаревшей классификации — главной подгруппы третьей группы), второго периода периодической системы химических элементов с атомным номером 5. Обозначается символом B (лат. Borum). В свободном состоянии бор — бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
У бора самый высокий предел прочности на разрыв 5,7 ГПа
В природе бор находится в виде двух изотопов 10В (20 %) и 11В (80 %)[6].
10В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому 10В в составе борной кислоты применяется в атомных реакторах для регулирования реактивности.
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
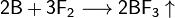
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
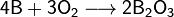
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
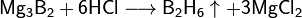
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
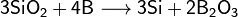
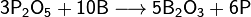
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты 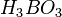 .
.
Оксид бора 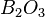 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
— типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
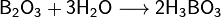
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), атетрабораты, например:
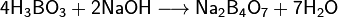
№27
Кислородные соединения бора
Оксид бора
Он может быть получен взаимодействием бора и кислорода или при нагревании борной кислоты
Свойства
В2О3 - это кислотный оксид, который медленно растворяясь в воде, дает борную кислоту:
В2О3 реагирует с основными оксидами, основаниями и солями.
Борная кислота
Обычно ее получают из буры, вытесняя более сильными кислотами:
Nа2В4О7 + Н2SО4 + 5Н2О = 4Н3ВО3 + Nа2SО4.
Н3ВО3 - очень слабая кислота, которая при нагревании может переходить в метаборную.
Борная кислота используется как консервирующее и дезинфицирующее средство.
Очень устойчив нитрид бора: кристаллический ВГ по твердости сравним с алмазом и является ценным абразивом, так как может использоваться при высоких температурах.
Соли
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты(содержащие анион BO33-), а тетрабораты, например:
4H3BO3 + 2NaOH = Na2B4O7 + 7Н2О
Поликислоты бора
Полиборные кислоты общей формулы n B2O3. m H2O (напр., тетраборная H2B4O7). H3BO3 — слабая трехосновная кислота;
Применяют для производства специального стекла и эмалей, в химической ибиологической практике для приготовления буферных растворов; в медицине как антисептическое средство(в виде водных растворов для полоскания полости рта и промывания глаз, в виде мази и присыпок призаболеваниях кожи).
№28
Физические свойства
Алюминий-серебристо-белый металл, обладающий высокой электропроводностью и теплопроводностью. (Теплопроводность алюминия в 1,8 раз больше, чем у меди, и в 9 раз больше, чем у нержавеющей стали.) Он имеет невысокую плотность - приблизительно втрое меньше, чем у железа, меди и цинка. И все же это очень прочный металл.
Три электрона из внешней оболочки атома алюминия делокализованы по кристаллической решетке металлического алюминия. Эта решетка имеет грансцентрированную кубическую структуру, подобную решетке олова и золота (см. разд. 3.2). Поэтому алюминий обладает хорошей ковкостью.
Химические свойства
Алюминий образует соединения ионного и ковалентного типа. При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°), O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель. Не допустить образования оксидной пленки можно, добавляя к алюминию такие металлы как галлий, индий или олово. Поверхность алюминия смачивают низкотемпературными сплавами на основе этих металлов.
Легко реагирует с простыми веществами:
с кислородом, образуя оксид алюминия.
с галогенами (кроме фтора), образуя хлорид, бромид или иодид алюминия.
с другими неметаллами реагирует при нагревании.
со фтором, образуя фторид алюминия.
с серой, образуя сульфид алюминия.
с азотом, образуя нитрид алюминия.
с углеродом, образуя карбид алюминия.
Сульфид и карбид алюминия полностью гидролизуются.
Со сложными веществами:
с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи).
со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
Легко растворяется в соляной и разбавленной серной кислотах.
При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия.
восстанавливает металлы из их оксидов (алюминотермия).
№29
Оксид и гидроксид алюминия, их амфотерность
Важнейшими соединениями алюминия является алюминий оксид и алюминий гидроксид.
Алюминий оксид Al2O3 - белая тугоплавкая кристаллическое вещество, нерастворимое в воде. В лабораторных условиях алюминий оксид добывают сжиганием алюминия или термическим разложением алюминий гидроксида:
4Al + 3O2 → 2Al2O3
2Al(OH)3 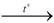 Al2O3 + 3H2O.
Al2O3 + 3H2O.
По химическим свойствам алюминий оксид являются амфотерными. Он реагирует с кислотами, проявляя свойства основных оксидов:
Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Реагируя с лугами, он проявляет свойства кислотных оксидов. В растворах щелочей образуются комплексные соединения:
Al2O3 + 2KOH + 3H2O = 2K [Al(OH)4].
При сплавлении образуются соли метаалюминиевои кислоты, например, метаалюминат калия:
Al2O3 + 2KOH 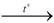 2KAlO2 + H2O.
2KAlO2 + H2O.
Естественную кристаллическую модификацию алюминий оксида (корунд) применяются в различных областях науки и производства. Рубины, например, является материалом для изготовления рабочих камней точных механизмов. Кристаллы корунда - рабочие тела лазеров. Рубины и сапфиры используют для отделки ювелирных изделий. Алюминий оксид является главной составляющей наждака - абразивного материала. Тугоплавкость и коррозионная стойкость алюминий оксида предопределяет его применение для изготовления термостойкого химической посуды, кирпича для кладки стекловаренных печей.
Алюминий гидроксид Al(OH)3 - это нерастворимое в воде кристаллическое вещество белого цвета. В лаборатории алюминий гидроксид добывают из растворимых солей алюминия при их взаимодействии с растворами щелочей, например:
AlCl3 + 3КOH = Al(OH)3 ↓ + 3КCl.
Полученный алюминий гидроксид имеет вид студенистого осадка.
Алюминий гидроксид проявляет амфотерные свойства и растворяется как в кислотах, так и в щелочах:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na[Al(OH)4].
При сплавлении алюминий гидроксида с натрий гидроксидом образуется натрий метаалюминат:
Al(OH)3 + NaOH 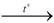 NaAlO2 + 2H2O.
NaAlO2 + 2H2O.
Способность алюминий гидроксида реагировать с кислотами используют в терапии. Он входит в состав лекарственных препаратов, используемых для снижения кислотности и уменьшение изжоги.
Итак, главными особенностями алюминий оксида и алюминий гидроксида является их амфотерными свойствами.
№30
Химия неорганических соединений углерода: углекислого газа и его производных.
Углерод образует два оксида – оксид углерода (II) СО и оксид углерода (IV) СO2. Оксид углерода (II) СО – бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит.
2СО + О2 = 2СО2.
Оксид углерода (II) способен отнимать кислород у оксидов металлов, т.е. восстанавливать металлы из их оксидов.
Fe2О3 + ЗСО = 2Fe + ЗСО2.
Оксид углерода (IV) СО2 – широко известный под названием углекислый газ – бесцветный, не имеющий запаха газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в 1 объеме воды растворяется 1 объем углекислого газа.
Углекислый газ СО2 – это типичный кислотный оксид: взаимодействует со щелочами (например, вызывает помутнение известковой воды), с основными оксидами и водой.
Углекислый газ получают, действуя на соли угольной кислоты – карбонаты растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии на мел или мрамор соляной кислоты.
СаСО3 + 2НСl = СаСl2 + Н20 + С02↑.
В промышленности углекислый газ получают обжигом известняка:
СаСО3 = СаО + С02↑.
№31
| Вся земная жизнь основана на углероде. Каждая молекула живого организма построена на основе углеродного скелета. |
Углерод может оставаться в растениях, пока растения не погибнут. Тогда их молекулы пойдут в пищу редуцентам (организмам, которые питаются мертвым органическим веществом и при этом разрушают его до простых неорганических соединений), таким как грибы и термиты. В конце концов углерод вернется в атмосферу в качестве CO2.
Растения могут быть съедены травоядными животными. В этом случае углерод либо вернется в атмосферу (в процессе дыхания животных и при их разложении после смерти), либо травоядные животные будут съедены плотоядными (и тогда углерод опять же вернется в атмосферу теми же путями).
Растения могут погибнуть и оказаться под землей. Тогда в конечном итоге они превратятся в ископаемое топливо — например, в уголь.
Если углерод вошел в состав осадочных отложений или ископаемого топлива, он изымается из атмосферы. На протяжении существования Земли изъятый таким образом углерод замещался углекислым газом, попадавшим в атмосферу при вулканических извержениях и других геотермальных процессах. В современных условиях к этим природным факторам добавляются также выбросы при сжигании человеком ископаемого топлива. В связи с влиянием CO2 на парниковый эффект исследование круговорота углерода стало важной задачей для ученых, занимающихся изучением атмосферы.
Составной частью этих поисков является установление количества CO2, находящегося в тканях растений (например, в только что посаженном лесу) — ученые называют это стоком углерода.
Углерод используют:
1) как топливо
2) как восстановитель (выплавка чугуна\железа)
3) для пр-ва алмазов Алмаз, графит, нанотрубка, лонсдейлит, фуллерен, карбин, графен.
Алмаз используется в с/х благодаря своему свойству исключительной твердости и очень высокой теплопроводности. Первое свойство используется при шлифовании поверхностей каких-либо материалов, второе — при составлении микросхем, в которых алмаз является перспективной подложкой для процессоров. Также алмаз является обязательным элементом и изготовлении сплавов стали и чугуна.
4) для синтеза др. веществ
и т. д.
На практике топливом считают только те вещества, которые воспламеняются при умереннойтемпературе, имеют высокую теплотворную способность и могут быть получены в достаточном количестведоступными средствами. Химическая реакция между горючими элементами (чаще всего это углерод и водород) и кислородом называется горением. В результате этого процесса из реагирующих компонентовобразуются продукты реакции (обычно двуокись углерода и пары воды) и выделяется теплота.Участвующие в химической реакции атомы не изменяются, а только перестраиваются в результате распадаодних молекул и образования других. Например, атом углерода в молекуле двуокиси углерода, являющейсяпродуктом химической реакции, точно такой же, каким он был до реакции в молекуле топлива.
Любое топливо является таковым только благодаря тому, чтосодержит водород и углерод.
Сравнение составов различных топлив показывает, что относительное содержание углерода по сравнению ссодержанием водорода уменьшается при переходе от твердых топлив к жидким и далее к газообразным. Всеэти топлива можно получать друг из друга, изменяя соотношение между содержанием углерода и водорода.Все они являются ценным сырьем для производства различных химических продуктов, горючего длядвигателей и масел для смазки, а также служат источниками тепла и электрической энергии.
№ 32
Наиболее распространенным соединением кремния является его диоксид SiO2, другое его название — кремнезем. В природе он образует минерал кварц (рис. 46) и многие разновидности, такие, как горный хрусталь и его знаменитая лиловая форма — аметист, а также агат, опал, яшма, халцедон, сердолик, которые известны как поделочные и полудрагоценные камни. Диоксид кремния — это также обычный и кварцевый песок.
Из разновидностей минералов на основе диоксида кремния — кремня, халцедона и других первобытные люди изготовляли орудия труда. Именно кремень, этот невзрачный и не очень прочный камень, положил начало каменному веку — веку кремневых орудий труда. Причин этому две: распространенность и доступность кремня, а также его способность образовывать при сколе острые режущие края.
Второй тип природных соединений кремния — это силикаты. Среди них наиболее распространены алюмосиликаты (понятно, что эти силикаты содержат алюминий). К алюмосиликатам относятся гранит, различные виды глин, слюды. Силикатом, не содержащим алюминий, является, например, асбест.
Важнейшее соединение кремния — оксид SiO2 необходим для жизни растений и животных. Он придает прочность стеблям растений и защитным покровам животных. Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки, острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра.
№33
Германий
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. Подобно кремнию, германий используется в качестве полупроводникового материала для изготовления микроэлектронных устройств, например транзисторов.
Олово
Олово - один из немногих металлов, известных человеку еще с доисторических времен. Олово и медь были открыты раньше железа
Олово обладает высокой коррозионной устойчивостью и поэтому используется для нанесения защитных покрытий на металлические предметы. Белая жесть, используемая для изготовления консервных банок, представляет собой тонкое листовое железо, покрытое тонким слоем олова.
Олово входит в состав различных сплавов, в том числе бронзы, подшипникового сплава и типографического сплава.Посудное олово – это сплав олова (или мышьяка) со свинцом, в который для повышения прочности добавляют медь. Оловянный припой представляет собой сплав олова со свинцом.
Свинец
Свинец используется для изготовления кровельного материала, оболочки кабелей, в свинцовых аккумуляторах и с древних времен применяется для изготовления монет, гирь, витражей, припоя и кухонной посуды. Со времен Древнего Рима свинец использовался для изготовления водопроводных и канализационных труб. Однако из-за токсичности свинца в настоящее время он больше не используется для этой цели.
Отходы, содержащие минеральные загрязнения, в основном, локализуются около берегов, лишь некоторая их часть выносится далеко за пределы территориальных вод. Особенно опасны загрязнения вод ртутью, поскольку заражение морских организмов может стать причиной отравления людей.
Образование кислотных дождей связано с поступлением во влажную атмосферу оксида серы и азота. Особую опасность представляют стационарные источники (ТЭС и др.). Кислотные дожди снижают плодородие почв, ухудшают здоровье населения.
Среди разнообразия химических веществ и физических факторов, поступающих в окружающую среду, наиболее опасными являются Канцерогены.
№34.
Из определений плотности газа установлено, что молекула азота двухатомна, т.е. молекулярная формула азота имеет вид NєN (или N2). У двух атомов азота три внешних 2 p -электрона каждого атома образуют тройную связь:N:::N:, формируя электронные пары. Измеренное межатомное расстояние N–N равно 1,095 Å. Как и в случае с водородом, существуют молекулы азота с различным спином ядра – симметричные и антисимметричные. При обычной температуре соотношение симметричной и антисимметричной форм равно 2:1. В твердом состоянии известны две модификации азота: a – кубическая и b – гексагональная с температурой перехода a ® b –237,39° С. Модификация b плавится при –209,96° С и кипит при –195,78° C при 1 атм (см. табл. 1).
Энергия диссоциации моля (28,016 г или 6,023Ч1023 молекул) молекулярного азота на атомы (N2 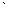 2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
№ 35
Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи
В больших количествах токсичен для человека.
аммиак не восстанавливается, т.к. атом азота находится в низшей (№ группы-8) степени окисления;
Аминами называются органические производные аммиака, в котором один, два
или все три атома водорода замещены на углеводородные радикалы (
предельные, непредельные, ароматические).
В зависимости от числа атомов водорода, замещенных в аммиаке на
углеводородные радикалы, различают первичные, вторичные и третичные амины:
R
R- NH2 R - NH - R' R - N - R"
первичный амин вторичный амин третичный амин
Где R, R', R'' - углеводородные радикалы.
Первичные, вторичные и третичные амины можно получить, проводя
алкилирование (введение алкильного радикала) аммиака. При этом происходит
постепенное замещение атомов водорода аммиака на радикалы
Для получения вторичных и третичных аминов можно использовать реакцию
аминов с галогеналкилами: (CH3)2NH + C2H5Br --- (CH3)2NC2H5 + HBr
Тритичные амины присоединяют галогенопроизводные углеводорода с
образованием тетраалкиламмониевых солей, например: (C2H5)3N + C2H5I --- [(C2H5)4N]I
№ 36
Известны несколько оксидов азота. Несолеобразующие и солеобразующие. Все оксиды азота, кроме N2O, ядовитые вещества.
Оксидазота (I)N2O — это бесцветный газ, со слабым запахом и сладким вкусом, растворим в воде, но не взаимодействует с ней. При высокой температуре разлагается. В смеси с кислородом N2O используется для наркоза «веселящий газ».
Оксидазота (II)NO – бесцветный газ, без запаха. Относится к несолеобразующим оксидам, в воде мало растворим. Оксид азота(II) NO на воздухе легко окисляется до оксида азота (IV).
Оксид азота(IV)NO2– ядовитый газ бурого цвета, имеет характерный запах.
Оксид азота (III)N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:
N2O3 + H2O → 2HNO2.
Оксид азота (V)N2O5 - бесцветные кристаллы, хорошо растворяющиеся в воде с образованием азотной кислоты:
N2O5 +H2O → 2HNO3.
Азотная кислота и ее соли. Чистая HNO3 бесцветная жидкость, на воздухе «дымит», смешивается с водой. На свету частично разлагается, приобретая бурую окраску.
Химические свойства. Проявляет все свойства кислот. Азотная кислота одна из наиболее сильных минеральных кислот.
1.В водных растворах она полностью диссоциирована на ионы:
HNO3 → H+ + NO-3
2. Реагирует с оксидами металлов:
MgO + 2HNO3 → Mg(NO3)2 + H2O,
3. Реагирует с основаниями:
Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O,
4. КонцентрированнаяHNO3 при взаимодействии с наиболее активными металлами до Al восстанавливается до N2О. Например:
4Ca + 10HNO3 → 4Ca(NO3)2 + N2O↑+ 5H2O
5. Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
4HNO3 + Ni → Ni(NO3)2 + 2NO2↑ + 2H2O.
6. Аналогично концентрированная HNO3 реагирует с неметаллами. Неметалл при этом окисляется. Например:
5HNO3 +Pо → HP+5O3 + 5NO2↑+ 2H2O.
Cоли азотной кислоты – нитраты при нагревании разлагаются по схеме:
левее Mg: MeNO3 → MeNO2 + O2
Mg – Cu: MeNO3 → MeO + NO2↑ + O2↑
правее Сu MeNO3 → Me + NO2↑ +O2↑
№ 37
Фосфор образует три аллотропных модификации: белый, красный и черный.
Химические свойства:
1) при нагревании Р4 обратимо диссоциирует:
2) свыше 2000 °C Р2 распадается на атомы:
3) фосфор образует соединения с неметаллами:
Непосредственно соединяется со всеми галогенами: 2Р + 5Cl2 = 2РCl5.
При взаимодействии с металлами фосфор образует фосфиды:
Соединяясь с водородом, образует газ фосфин: Р4 + 6Н2 = 4РН3
При взаимодействии с кислородом образует ангидрид Р2О5: Р4 + 5О2 = 2Р2О5.
Фосфор образует несколько аллотропных видоизменений – модификаций. Явление аллотропных модификаций у фосфора вызвано образованием различных кристаллических форм. Белый фосфор (Р4) имеет молекулярную кристаллическую решетку, красный и черный – атомную. Различие в строении кристаллической решетки обуславливает и различие в их физических и химических свойствах. Белый фосфор – сильный яд, даже в малых дозах действует смертельно. В твердом состоянии получается при быстром охлаждении паров фосфора. В чистом виде совершенно бесцветен, прозрачен, по внешнему виду похож на воск: на холоде хрупок, при температуре выше 15 °C – мягкий, летуч. Прочность связи в молекуле невелика, чем обусловлена высокая химическая активность. Белый фосфор быстро окисляется на воздухе, при этом светится в темноте – превращение химической энергии в световую; самовоспламеняется на воздухе, при слабом нагревании, незначительном трении:
При длительном нагревании белый фосфор превращается в красный. Белый фосфор применяется для изготовления боеприпасов артиллерийских снарядов, авиабомб, предназначенных для образования дымовых завес. Широкого применения не имеет.
Красный фосфор – порошок красно-бурого цвета, неядовит, нелетуч, нерастворим в воде и во многих органических растворителях и сероуглероде; не воспламеняется на воздухе и не светится в темноте. Только при нагревании до 260 °C воспламеняется. При сильном нагревании, без доступа воздуха, не плавясь (минуя жидкое состояние) испаряется – сублимируется. При охлаждении превращается в белый фосфор. Идет на изготовление спичек: красный фосфор в смеси с сульфидом сурьмы, железным суриком, с примесью кварца и клея наносят на поверхность спичечной коробки. Также красный фосфор применяется в приготовлении фармацевтических препаратов.
Черный фосфор получается при сильном нагревании и при высоком давлении белого фосфора. Черный фосфор тяжелее других модификаций. Применяется очень редко – как полупроводник в составе фосфата галлия и индия в металлургии.
№ 38
Ортофо́сфорная кислота́ (фо́сфорная кислота́) — неорганическая кислота средней силы, с химической формулой H3PO4. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85%-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
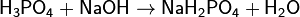 (дигидрофосфат натрия)
(дигидрофосфат натрия)
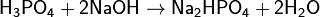 (гидрофосфат натрия)
(гидрофосфат натрия)
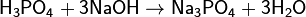 (фосфат натрия)
(фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
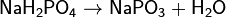
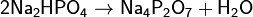
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Фосфор — важный элемент питания растений. Растения потребляют его главным образом в виде анионов H2PO4-; (или HPO42-) из солей ортофосфорной кислоты (H3PO4), а также из солей полифосфорных кислот (после их гидролиза).
Фосфор входит в нуклеиновые кислоты и нуклеопротеиды, участвующие в построении цитоплазмы и ядра клеток. Он содержится в фитине — запасном веществе семени, который используется как источник фосфора во время прорастания, а также в фосфатидах, сахарофосфатах, витаминах и многих ферментах.
В тканях растений присутствуют в небольших количествах также неорганические фосфаты, которые играют важную роль в создании буферной системы клеточного сока и служат резервом фосфора для образования различных фосфорорганических соединений.
В растительной клетке фосфор играет исключительно важную роль в энергетическом обмене, участвует в разнообразных процессах обмена веществ, деления и размножения. Особенно велика роль этого элемента в углеводном обмене, в процессах фотосинтеза, дыхания и брожения.
Фосфорные удобрения в зависимости от растворимости и доступности для растений подразделяют на три группы:
Удобрения, содержащие фосфор в водорастворимой форме — суперфосфат простой и суперфосфат двойной. Фосфор из этих удобрений легко доступен растениям.
Удобрения, фосфор которых не растворим в воде, но растворим в слабых кислотах (2%-ной лимонной кислоте) или в щелочном растворе лимоннокислого аммония, — преципитат, томасшлак, термофосфаты, обесфторенный фосфат. Фосфор в этих удобрениях находится в доступной растениям форме.
Удобрения, не растворимые в воде, и плохо — в слабых кислотах, полностью растворимые только в сильных кислотах, — фосфоритная мука, костяная мука. Это более труднодоступные источники фосфора для растений.
№ 39
Кислород — O2 (O=O, O::O) -газ без цвета, без запаха. Аллотропная модификация — озон O3 — бесцветный газ со специфическим запахом (запах «после грозы»)
Химические свойства
Свойства кислорода
| Окислительные свойства | Восстановительные свойства |
| 1. Водород + кислород: o 2H2 + O2 = 2H2O этокачественная реакция на кислород - процесс идет с характерным хлопком. o H2 + O2 = H2O2 — перекись водорода 2. Металлы + кислород: o 4Li + O2 = 2Li2O — основной оксид 3. Неметалл + O2: o S + O2 = SO2 — кислотный оксид 4. Оксиды + кислород: o 4FeO + O2 = 2Fe2O3 — реакция идет с основными оксидами в невысших степенях окисления o 2SO2 + O2 = 2SO3 — реакция идет с кислотными оксидами в невысших степенях окисления | Кислород может проявлять восстановительные свойства только к элементу, у которого больше электроотрицательность, т.е., он должен стоять впериодической системе элементов правее кислорода. Это КОРОЛЬ НЕМЕТАЛЛОВ — F: · F2 + O2 = OF2 (здесь кислород проявляет степень окисления +2) |
Кислород играет важнейшую роль в жизни большинства живых организмов нашей планете. Он необходим всем для дыхания. Кислород не всегда входил в состав земной атмосферы. Он появился в результате жизнедеятельности фотосинтезирующих организмов. Под действием ультрафиолетовых лучей он превращался в озон. По мере накопления озона произошло образование озонового слоя в верхних слоях атмосферы. Озоновый слой, как экран, надежно защищает поверхность Земли от ультрафиолетовой радиации, гибельной для живых организмов.
Современная атмосфера содержит едва ли двадцатую часть кислорода, имеющегося на нашей планете. Главные.запасы кислорода сосредоточены в карбонатах, в органических веществах и окислах железа, часть кислорода растворена в воде. В атмосфере, по-видимому, сложилось приблизительное равновесие между производством кислорода в процессе фотосинтеза и его потреблением живыми организмами. Но в последнее время появилась опасность, что в результате человеческой деятельности запасы кислорода в атмосфере могут уменьшиться. Особую опасность представляет разрушение озонового слоя, которое наблюдается в последние годы. Большинство ученых связывают это с деятельностью человека.
Круговорот кислорода в биосфере необычайно сложен, так как с ним вступает в реакцию большое количество органических и неорганических веществ, а также водород, соединяясь с которым кислород образует воду.
№ 40
Простейшим инаиболее важным водородным соединением серы является сероводород, который в водном растворе ведет себя как очень слабая двухосновная кислота (К О. Все гидросульфиды хорошо растворимы в воде.
Молекула сероводорода Сероводород – бесцветный газ с запахом тухлых яиц. Он хорошо растворяется в воде (при 20 ° С в 1 объеме воды растворяется 2,5 объема сероводорода). Сероводород можно получить непосредственным соединением серы с водородом при нагревании, но обычно его добывают действием разбавленной соляной или серной кислот на сульфид железа: 2HCl + FeS = FeCl 2 + H 2 S
Эту реакцию часто проводят в аппарате кипп.
Сероводород – очень ядовитый газ, который неблагоприятно действует на нервную систему. Поэтому работать с ним надо в вытяжных шкафах или в плотно закрытых приборах.
Се́рная кислота́ H₂SO₄ — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом. Если молярное отношение SO₃: H₂O < 1, то это водный раствор серной кислоты, если > 1, — раствор SO₃ в серной кислоте.
Сульфаты - соли серной кислоты. Они имеют светлую окраску, небольшую твёрдость, многие из них растворимы в воде.
Основная масса сульфатов имеет осадочное происхождение - это химические морские и озёрные осадки. Многие сульфаты являются минералами зоны окисления, известны сульфаты и как продукты вулканической деятельности. Различают сульфаты безводные, водные и сложные, содержащие кроме общего для всех анионного комплекса [SO4]2- также добавочные анионы (ОН)-.
Во всех этих минералах в их кристаллической структуре имеются обособленные сложные анионы — тетраэдры. Вообще сульфатов в природе мало, больше всего сульфатов железа, натрия, калия, алюминия, кальция, бария. Самыми распространенными являются гипс, ангидрит, барит, алунит, тенардит, мирабилит. Почти все сульфаты — это экзогенные минералы, исключение составляют барит, алунит.
 2018-01-21
2018-01-21 1314
1314