- характеристика элемента магния: электронное строение, возможные степени окисления, основные соединения: оксид, гидроксид, соли. Что такое карбонизация и какова ее роль в строительстве.
Магний (лат. Magnesium), Mg (читается «магний») – химический элемент II А группы третьего периода периодической системы Менделеева, атомный номер 12, атомная масса 24,305.
Электронная конфигурация нейтрального атома 1s2 2s2 2p6 3s2 = [10Ne] 3s2, согласно которой магний в соединениях может иметь степень окисления +2 и 0.
Простое вещество магний — легкий, серебристо-белый блестящий металл.
Магний относится к щелочноземельным металлам
Основные соединения:
Оксид магния (жжёная магнезия, периклаз) — химическое соединение с формулой MgO (молярная масса – 40,3044 г/моль, белые кристаллы, нерастворимые в воде, пожаро- и взрывобезопасен.
Основная форма — минерал периклаз.
Физические свойства.
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике, нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Плотность – 3,58 г/см³, растворимость в воде – 0,0086 г/100 мл (30°С), температура плавления — 2825 °C, температура кипения — 3600 °C, плотность – 3,58 г/см3.
Химические свойства.
Легко реагирует с разбавленными кислотами и водой с образованием солей и Mg(OH)2:
MgO + 2HCl = MgCl2 + H2O
MgO + H2O = Mg(OH)2
Получение.
Оксид магния получают обжигом минералов магнезита и доломита.
MgCO3 = MgO + CO2
Применение.
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины. Сверхлегкая окись магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
Гидроксид магния — основной гидроксид металла магния. Слабое нерастворимое основание.
При стандартных условиях гидроксид магния представляет собой бесцветные кристаллы с гексагональной решёткой. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде, но растворим в солях аммония. Является слабым основанием. Встречается в природе в виде минерала брусита.
Получение.
Взаимодействие растворимых солей магния с щелочами:
В общем виде:
Mg2+ + 2OH- = Mg(OH)2¯
Примеры:
MgCl2 + 2NaOH = Mg(OH)2¯ + 2NaCl
Mg(NO3)2 + 2KOH = Mg(OH)2¯ + 2KNO3
Взаимодействие раствора хлорида магния с обожжённым доломитом:
MgCl2+ CaO×MgO + 2H2O = 2 Mg(OH)2¯ + CaCl2
Взаимодействие металлического магния с парами воды:
Mg + 2H2O = Mg(OH)2¯ + H2
Химические свойства.
Как и все слабые основания, гидроксид магния термически неустойчив. Разлагается при нагревании до 350 °C:
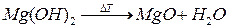
Взаимодействует с кислотами с образованием соли и воды (реакция нейтрализации):
Mg(OH)2+ 2HCl = MgCl2 + 2H2O
Mg(OH)2+ H2SO4 = MgSO4 + 2H2O
Взаимодействие с кислотными оксидами с образованием соли и воды:
Mg(OH)2+ SO3 = MgSO4 + H2O
Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов:
Mg(OH)2+ 2NaOH = Na2[Mg(OH)4]
Mg(OH)2 + Sr(OH)2 = Sr[Mg(OH)4]
Применение.
Гидроксид магния применяется для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст.
В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное.
В Европейском союзе гидроксид магния зарегистрирован в качестве пищевой добавки E528.
Соли магния.
Большинство солей магния хорошо растворяется в воде. Ион Mg2+ придает растворам горький вкус. Галогениды магния, за исключением MgF2, сильно гигроскопичны — на воздухе расплываются.
Хлористый магний MgCl2 (хлорид магния) безводный плавится при 718°. В присутствии следов воды «дымит» на воздухе — разлагается на НСl и MgO. Из водного раствора выделяются бесцветные кристаллогидраты с 1, 2, 4, 6, 8 и 12 молекулами воды. В интервале температур от —3,4 до 116,7° устойчив кристаллогидрат MgCl2 × 6H20, который встречается в природе в виде минерала бишофита, а в больших количествах получается при упаривании морских рассолов. Хлорид магния образует двойные соли, из которых исключительно важен минерал карналлит KCl × MgCl2 × 6H2O — источник получения магния и хлорида калия.
Применение.
1. Хлорид магния применяют главным образом в производстве металлического магния, MgCl2 × 6H20 используется для получения магнезиальных цементов.
2. Используется для обработки ледяного и снежного покрова в качестве добавки. В результате реакции со снегом вызывает его таяние. Имеет 3-й класс опасности (умеренно опасные вещества) и агрессивные коррозионные свойства
Гидрокарбонат магния — кислая соль магния и угольной кислоты с формулой Mg(HCO3)2, существует только в водных растворах.
Получение.
Пропускание углекислого газа через суспензию карбоната магния:
MgCO3 + CO2 + H2O = Mg(HCO3)2
Физические свойства.
Гидрокарбонат магния существует только в водных растворах.
Наличие гидрокарбоната магния в воде обуславливает ее временную жесткость.
Химические свойства.
При концентрировании раствора гидрокарбонат магния разлагается:
Mg(HCO3)2 = MgCO3 + CO2 + H2O
Гидроортофосфат магния (двузамещённый фосфорнокислый магний) — кислая соль магния и ортофосфорной кислоты с формулой MgHPO4, слабо растворяется в воде, образует кристаллогидраты.
Получение.
Действием ортофосфорной кислоты на оксид или карбонат магния:
MgO + H3PO4 = MgHPO4 + H2O
MgCO3 + H3PO4 = MgHPO4+ CO2+ H2O
Действием двузамещённого ортофосфата натрия на хлорид магния:
MgCl2 + 2Na2HPO4 = MgHPO4 + 2NaCl
Разложением дигидроортофосфата магния:
Mg(H2PO4)2 = MgHPO4 + H3PO4
Гидроортофосфат магния образует белые кристаллы, которые являются кристаллогидратами: при температурах до 225°С образуется моногидрат MgHPO4 • H2O, плотность 2,32 г/см³, при температуре 36°С образуется тригидрат MgHPO4 • 3H2O, плотность 2,10 г/см³, при комнатной температуре образуется гептагидрат MgHPO4 • 7H2O.
При нагревании переходит в пирофосфат:
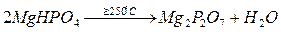
Применение.
Используется в пищевой добавке Е343.
Дигидроортофосфат магния — кислая соль металла магния и ортофосфорной кислоты с формулой Mg(H2PO4)2, бесцветные гигроскопичные кристаллы, растворимые в воде, образует кристаллогидраты.
Получение.
Растворение в ортофосфорной кислоте гидроксида или оксида магния:
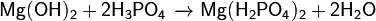
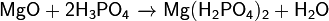
Дигидроортофосфат магния образует бесцветные кристаллы.
Образуется кристаллогидраты состава Mg(H2PO4)2 • nH2O, где n = 2, 4, 6.
Карбид магния — бинарное неорганическое соединение магния и углерода с формулой MgС2. Известен также карбид магния с формулой Mg2C.
Получение.
Спеканием фторида магния и карбида кальция:
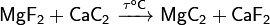
Пропуская ацетилен над порошком магния:
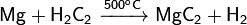
Восстанавливая пентан порошком магния при 650°С можно получить более сложный карбид Mg2С3.
При нагревании разлагается с образованием промежуточного карбида Mg2С3:
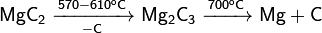
Взаимодействует с водой:
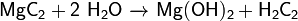
Карбонат магния, магний углекислый, MgCO3 — магниевая соль угольной кислоты.
Свойства.
Белые кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Мg(HCO3)2. Из водных растворов в отсутствие избытка CO2 выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли, к которым относится и природный минерал доломит MgCO3 · CaCO3.
Распространённость в природе.
Карбонат магния широко распространён в природе в виде минерала магнезита.
Применение.
Основной карбонат магния 3MgCO3 · Mg(OH)2 · 3H2O (так называемая белая магнезия) применяют как наполнитель в резиновых смесях, для изготовления теплоизоляционных материалов.
Карбонат магния необходим в производстве стекла, цемента, кирпича.
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой; температура плавления 426 °C (с разложением). Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты.
Компонент сложных удобрений, поскольку Магний входит в состав хлорофилла, который необходим для фотосинтеза, способствует повышению активности многих ферментов и выступает в роли транспортера фосфора. Высокая растворимость и низкая электропроводность делают продукт исключительно подходящим для листовой подкормки и фертигации, особенно при использовании оросительных вод с высокой концентрацией солей. Удобрение используется для корневого и некорневого питания овощных, ягодных, плодовых культур, винограда; окислитель в пиротехнических составах.
Карбонизация — насыщение какого-либо раствора углекислым газом. Применяется в строительстве.
Карбонизация минералов – кремневая кислота в силикатах замещается угольной кислотой с образованием карбонатов. Из карбонатов породообразующим минералом в осадочных породах является и чаще встречается кальцит (известковый шпат) СаСО3. Реже встречается магнезит – МgСО3 и доломит – CaMg(CO3)2. В чистой воде, не содержащей углекислоту, кальцит растворяется в небольшом количестве (0,03 г на литр воды); магнезит практически не растворяется. Если вода содержит углекислоту, кальцит растворяется легко с образованием кислого углекислого кальция, хорошо растворимого в воде – Са(НСО3)2.
Карбонизация — это изменения, которые возникают в бетоне на портландцементе при действии на него С02 воздуха. Особенно сильное влияние испытывает гидроокись кальция Са(ОН)2 в присутствии влаги. Гидроокись кальция при поглощении углекислого газа превращается в карбонат кальция. Карбонат кальция плохо растворяется в воде и, образуясь, стремится герметически закрыть поры на поверхности бетона (имеется в виду плотный, водонепроницаемый бетон).
Обычно значение рН поровой воды в бетоне находится в пределах от 10,5 до 11,5. Если вследствие карбонизации оно уменьшится до 9 и ниже, то возможна коррозия арматуры. Следовательно, толщина карбонизируемого слоя является важным фактором для защиты арматуры: чем глубже карбонизация, тем больше опасность коррозии стали. Глубину карбонизации можно определить, обрабатывая бетон фенолфталеином. О наличии щелочных свойств при действии фенолфталеина свидетельствует появление розового цвета, тогда как бетон, подвергшийся карбонизации, сохраняет свою первоначальную окраску.
Высококачественный плотный бетон подвергается карбонизации очень медленно. Маловероятно, чтобы карбонизация наблюдалась на глубине более 5—10 мм даже после эксплуатации в течение 50 лет. С другой стороны, глубина карбонизации низкопрочного водопроницаемого бетона может достигать 25 мм менее чем за 10 лет. Опыт показывает, что бетонные изделия низкого качества особенно подвержены карбонизации.
- характеристика элемента кальция: электронное строение, возможные степени окисления, основные соединения: оксид, гидроксид, соли.
Кальций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca (лат. Calcium). Электронное строение 1s2 2s2 2p6 3s2 3p6 4s2 = [18Ar]4s2, степени окисления +2, 0. Относится к щелочноземельным металлам.
Простое вещество кальций — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета. Получение в промышленности: электролиз расплава хлорида кальция.
Оксид кальция CaO – основный оксид, негашёная известь. Белый, гигроскопичный. Тугоплавкий, термически неустойчивый, летучий при прокаливании. Энергично реагирует с водой (с высоким экзо-эффектом), образует сильнощелочной раствор, процесс называется гашением извести. Реагирует с кислотами, оксидами металлов, неметаллов. Применяется для синтеза других соединений кальция, компонент вяжущих мматериалов в строительстве.
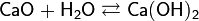 + 64Дж
+ 64Дж
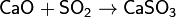
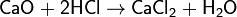
Получение в промышленности – обжиг известняка (900 – 1200оС)
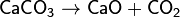
Гидроксид кальция Ca(OH)2 – гашеная известь, основный гидроксид. Разлагается при умеренном нагревании. Белый, гигроскопичный. Поглощает влагу и углекислый газ из воздуха. Малорастворим в хол. воде, ещё меньше – в кипящей воде. Прозрачный раствор (известковая вода) быстро мутнеет из-за выпадения осадка гидроксида (суспензию называют известковое молоко). Качественная реакция – пропускание углекислого газа через известковую воду с появлением осадка СаСО3 и переходом его в раствор. Реагирует с кислотами и кислотными оксидами, вступает в реакции ионного обмена.
Применяется в строительстве для приготовления известковых строительных растворов (песок + гашеная известь + вода), служащих связывающим материалом для каменной и кирпичной кладки, отделки (оштукатуривания) стен и других строительных целей. Отвердевание таких растворов обусловлено поглощением СО2 из воздуха.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O,
Реагирует с солями, если образуется осадок:
Ca(OH)2 + Na2SO3→CaSO3↓ + 2NaOH
Соли кальция.
Сульфат кальция (CaSO4) — неорганическое соединение, кальциевая соль серной кислоты.
Находится в природе в виде дигидрата CaSO4? 2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
Хлорид кальция, CaCl2 — кальциевая соль соляной кислоты.
Обладает высокими гигроскопическими свойствами. Растворимость (г на 100 г H2O): 74 (20 °C) и 159 (100 °C). Водные растворы хлорида кальция замерзают при низких температурах (20%-ный — при −18,57 °C, 30%-ный — при −48 °C).
Образует гидрат CaCl2·6H2O, устойчивый до 29,8 °C; при более высоких температурах из насыщенного раствора выпадают кристаллогидраты с 4, 2 и 1 молекулами H2O. При смешении CaCl2*6H2O (58,8 %) со снегом или льдом (41,2 %) температура понижается до -55 °C (криогидратная точка).
Хлорид кальция получают как побочный продукт в производстве соды.
В химической лаборатории хлорид кальция применяется в качестве наполнителя для осушающих трубок, также называемых хлоркальциевыми, предназначенных для изоляции веществ в сосуде от водяных паров атмосферы и для осушки газов.
Хлорид кальция также применяют как ускоритель схватывания цемента;
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула —CaCO3. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц. Нерастворим в воде и этаноле.
Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
- примеры, иллюстрирующие применение оксидов и гидроксидов кальция и магния в строительстве.
Оксид и гидроксид кальция:
При побелке помещений.
При побелке деревянных заборов и обмазывании стропил — для защиты от гниения и возгорания.
Для приготовления известкового строительного раствора. Известь применялась для строительной кладки с древних времён. Смесь обычно приготавливают в такой пропорции: к одной части смеси гидроксида кальция (гашёной извести) с водой добавляют три-четыре части песка (по массе). При этом происходит затвердевание смеси по реакции: Ca(OH)2 + CO2 → CaCO3↓ + H2O. Это экзотермическая реакция, выделение энергии составляет 27 ккал (113 кДж).
Как видно из реакции, в ходе её выделяется вода. Это является отрицательным фактором, так как в помещениях, построенных с помощью известкового строительного раствора, долгое время сохраняется повышенная влажность. В связи с этим, а также благодаря ряду других преимуществ перед гидроксидом кальция, цемент практически вытеснил его в качестве связующего строительных растворов. Более того, он также недопустим к применению при кладке печей, поскольку под воздействием высоких температур выделяется удушливый диоксид углерода.
Для приготовления силикатного бетона. Состав силикатного бетона одинаков с составом известкового строительного раствора, однако он готовится другим методом — смесь оксида кальция и кварцевого песка обрабатывается не водой, а перегретым (174,5-197,4 °C) водяным паром в автоклаве при давлении 9-15 атмосфер.
При изготовлении силикатного кирпича.
Оксид и гидроксид магния:
для производства комбинированных систем из огнеупорных материалов (магнезитовых строительных плит), для производства цементов. Оксид магния (каустический магнезит) используется в качестве вяжущего вещества, которое при затворении раствором MgCl2 способно быстро твердеть и набирать прочность на воздухе.
- жесткость природных вод: определение, виды жесткости, методы устранения жесткости воды: физические, химические (уравнения реакций), физико-химические.
Природная вода, содержащая в растворе большое количество солей кальция или магния, называется жесткой водой в противоположность мягкой воде, содержащей мало солей кальция и магния или совсем не содержащей их.
Суммарное содержание этих солей в воде называется ее общей жесткостью. Она подразделяется на карбонатную и некарбонатную жесткость.
Первая из них обусловлена присутствием гидрокарбонатов кальция и магния, вторая — присутствием солей сильных кислот — сульфатов или хлоридов кальция и магния. При длительном кипячении воды, обладающей карбонатной жесткостью, в ней появляется осадок, состоящий главным образом из СаСО3, и одновременно выделяется СО2.
Оба эти вещества появляются вследствие разложения гпдрокарбоната кальция:
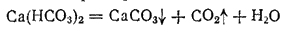
Поэтому карбонатную жесткость называют также временной жесткостью. Количественно временную жесткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при ее кипячении в течение часа. Жесткость, остающаяся после такого кипячения, называется постоянной жесткостью.
Жесткость воды выражают суммой миллиэквивалентов ионов кальция и магния, содержащихся в воды. Один миллиэквивалент жесткости отвечает содержанию 20,04 мг/л или 12,16 мг/л.
Жесткость природных вод изменяется в широких пределах. Она различна в разных водоемах, а в одной и той же реке изменяется в течение года (минимальна во время паводка). Жесткость вод морей значительно выше, чем рек и озер. Так, вода Черного моря имеет общую жесткость 65,5 мэкв/л. Среднее значение жесткости воды мирового океана 130,5 мэкв/л (в том числе на приходится 22,5 мэкв/л, на мэкв/л).
Присутствие в воде значительного количества солей кальция или магния делает воду непригодной для многих технических целей. Так, при продолжительном питании паровых котлов жесткой водой их стенки постепенно покрываются плотной коркой накиии. Такая корка уже при толщине слоя в сильно понижает передачу теплоты стенками котла и, следовательно, ведет к увеличению расхода топлива. Кроме того, она может служить причиной образования вздутий и трещин как в кипятильных трубах, так и на стенках самого котла.
Жесткая вода не дает пены с мылом, так как содержащиеся в мыле растворимые натриевые соли жирных кислот —пальмитиновой и стеариновой — переходят в нерастворимые кальциевые соли тех же кислот:
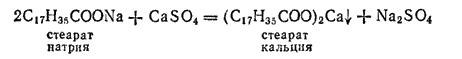
Жесткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при крашении.
Постоянная жесткость воды обусловлена присутствием в ней преимущественно сульфатов и хлоридов кальция и магния и не устраняется кипячением. Сумма временной (устранимой) и постоянной жесткости составляет общую жесткость воды.
Существуют различные способы определения жесткости.
Рассмотрим два из них:
1) определение временной жесткости с помощью титрованного раствора хлористоводородной кислоты
2) комплексометрический метод определения общей жесткости.
При титровании образца воды хлористоводородной кислотой в присутствии метилового оранжевого происходит разложение бикарбонатов, обусловливающих временную жесткость:
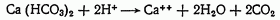
Методика определения. Отбирают в коническую колбу пипеткой или мерным цилиндром 100 мл исследуемой воды, добавляют 2-3 капли метилового оранжевого и титруют 0,1 и. раствором HCl до появления оранжевой окраски.
Расчет результате анализа. 1 мл 0,1 н. раствора HCl соответствует 0,1/1000 г-экв или 0,1 мг-экв Ca2+. V(HCl) соответствует 0,1 V(HCl) /1000 г-экв или 0,1 V(HCl) мг-экв Ca2+. 0,1 V(HCl) мг-экв находится в объеме VA. Чтобы выразить жесткость в миллиграмм-эквивалентах на 1л воды, нужно найденную величину разделить на VA и умножить на 1000, т. е. жесткость исследуемой воды равна:
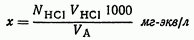
Методы устранения.
Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок.
Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдаёт ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %.
Различают нанофильтрацию (условный диаметр отверстий мембраны равен единицам нанометров) и пикофильтрацию (условный диаметр отверстий мембраны равен единицам пикометров).
В качестве недостатков данного метода следует отметить:
- необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану;
- относительно высокая стоимость 1 л получаемой воды (дорогое оборудование, дорогие мембраны);
- низкую минерализацию получаемой воды (особенно при пикофильтрации). Вода становится практически дистиллированной.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Полностью очистить воду от солей жёсткости можно дистилляцией.
 2015-02-15
2015-02-15 23345
23345