С повышением температуры скорости химических реакций сильно возрастают.
Существует эмпирическое правило Вант-Гоффа:
при повышении температуры на 10 °С скорость реакции (константа скорости) увеличивается в 2 - 4 раза.
Математически правило Вант-Гоффа можно записать следующим образом:
v2 k2 DT /10
¾¾ = ¾¾ = g, (3)
v1 k1
где g = 2 ¸ 4 - температурный коэффициент реакции,
v1 и v2(k1 и k2)-скорости (константы скорости) реакций
при температурах Т1 и Т2 соответственно, D Т = Т2 - Т1.
ПРИМЕР 4. Как изменится скорость реакции при увеличении температуры на 30 °С, если температурный коэффициент скорости реакции g = 3?
D T = 30, т.о. скорость реакции увеличится в vT+30/vT = 330/10 = 27 раз.
Правило Вант-Гоффа приближенное. Более точно температурная зависимость скорости реакции выражается уравнением Аррениуса: ln k = ln k0 - Eакт/ (RT)
где k0 - предэкспоненциальный множитель,
Еакт - энергия активации,
R - универсальная газовая постоянная.
Энергия активации - минимальная избыточная энергия взаимодействующих частиц, необходимая для протекания реакции (рис. 1, а).
|
|
|
 E
E

Еакт
 а Рис. 1. Изменение энергии в ходе
а Рис. 1. Изменение энергии в ходе

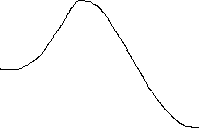
 некаталитической (а) и
некаталитической (а) и
 исх б каталитической (б) реакций.
исх б каталитической (б) реакций.
 |
прод
 ход реакции
ход реакции
Зная температурный коэффициент реакции (g) в интервале температур от Т1 до
Т2 = Т1+10, можно оценить величину энергии активации по уравнению: Еакт» 0,1 × R × T1 × T2 × ln g (4)
Катализ.
Многие химические реакции, вполне возможные с точки зрения термодинамики, протекают с малой скоростью. В присутствии некоторых веществ скорость реакции резко возрастает, хотя в стехиометрическом уравнении реакции эти вещества отсутствуют.
Подобные вещества, оказывающие влияние на скорость процесса, но формально в нем не участвующие, называются катализаторами. (Вещества, уменьшающие скорость реакции, называются ингибиторами).
Если катализатор находится в одной фазе с реагентами, говорят о гомогенном катализе, если реагенты и катализатор находятся в разных фазах - о гетерогенном катализе.
Скорость реакции в присутствии катализатора возрастает за счет снижения энергии активации (рис. 1, б). Это приводит к увеличению скоростей как прямой, так и обратной реакций. При этом не происходит изменения направления реакции и смещения состояния химического равновесия, увеличивается лишь скорость его установления.
В гомогенном катализе влияние катализатора сводится к образованию промежуточных соединений на первой стадии и конечного продукта с выделением катализатора - на второй.
ПРИМЕР 5. Реакция разложения пероксида водорода Н2О2 в присутствии хромата калия K2CrO4 протекает в две стадии, но суммарно выражается химическим уравнением следующим образом:
|
|
|
2 Н2О2 = 2 H2O + O2 , так как
катализатор, вступая в реакцию на первой стадии, полностью выделяется на второй (в результате реакции катализатор не расходуется).
При гетерогенном катализе ускорение реакции происходит за счет активирования молекул при их адсорбции на поверхности катализатора. Теория гетерогенного катализа не нашла еще своего завершения, поэтому разработка катализаторов для того или иного процесса является результатом длительных экспериментов.
Катализаторы характеризуются избирательностью (селективностью), т.е. ускоряют одни процессы, мало влияя на другие. В присутствии различных катализаторов превращение одного и того же вещества может идти в различных направлениях.
ПРИМЕР 6. Разложение этилового спирта может идти по трем различным механизмам.
В зависимости от природы катализатора происходит ускорение (преимущественное протекание) соответствующей реакции:
Al2O3 H3PO4
C2H4 + H2O ¾¾¾¾¾C2H5OH¾¾¾¾¾® (C2H5)2 + H2O
этилен ½Cu, Ni диэтиловый эфир
¯
CH3CHO + H2
ацетальдегид
 2018-01-21
2018-01-21 294
294








