Опыт 1. Получение и свойства этилена.
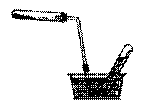 В сухую пробирку наливают 1 мл этилового спирта и осторожно при встряхивании приливают 3-4 мл концентрированной серной кислоты. В реакционную смесь помещают кипятильные камешки (для равномерного кипения). Пробирку соединяют с газоотводной трубкой, содержащей для улавливания побочных продуктов ловушку с гранулированной натронной известью и закрепляют в штативе в положении, указанном на рисунке.
В сухую пробирку наливают 1 мл этилового спирта и осторожно при встряхивании приливают 3-4 мл концентрированной серной кислоты. В реакционную смесь помещают кипятильные камешки (для равномерного кипения). Пробирку соединяют с газоотводной трубкой, содержащей для улавливания побочных продуктов ловушку с гранулированной натронной известью и закрепляют в штативе в положении, указанном на рисунке.
 |
Рисунок 1. Прибор для получения этилена: Рисунок 2. Прибор для сбора газа
1 – пробирка со смесью для получения этилена; вытеснением воды
2 – кипятильные камешки; 3 – хлоркальциевая трубка с натронной известью.
Натронная известь не должна плотно заполнять ловушку, чтобы образующиеся при реакции газы не выбили пробку из пробирки и не произошел выброс реакционной смеси. Рядом со штативом ставят кристаллизатор с водой и пять пробирок (в переносном штативе). В первую наливают 3-4 мл бромной воды, во вторую – 2 мл 2%-ного раствора перманганата калия и 0,5 мл 10%-ного раствора карбоната натрия, в третью – 2 мл 1%-ного раствора перманганата калия и 1 каплю концентрированной серной кислоты, четвертую и пятую пробирки полностью заполняют водой. Пробирку с реакционной смесью для получения этилена осторожно нагревают так, чтобы кипящую жидкость не перебросило в отводную трубку.
Выделяющийся этилен пропускают через бромную воду в первой пробирке, затем через щелочной раствор перманганата калия во второй пробирке и через подкисленный раствор перманганата калия в третьей пробирке. Отмечают наблюдаемые изменения и скорость, с которой они происходят.
Затем этилен поджигают у конца газоотводной трубки и отмечают характер пламени. В пламя вносят фарфоровую чашку и наблюдают образование на ней черного пятна сажи вследствие неполного окисления углерода.
Продолжая нагревать смесь, берут из штатива заполненную водой пробирку, закрывают отверстие пальцем, переворачивают и погружают в кристаллизатор с водой; под водой отверстие открывают, подводят под него конец газоотводной трубки и собирают этилен в пробирку (рис. 2), наблюдая, как его пузырьки вытесняют из пробирки воду. Когда пробирка полностью заполнится газом, ее отверстие под водой закрывают пальцем и вынимают из кристаллизатора. Пробирку (не открывая) переворачивают отверстием вверх, палец убирают и поджигают этилен у отверстия пробирки горящей спичкой, обращая внимание на характер горения. Чтобы газ горел у отверстия пробирки, следует сразу после поджигания наливать в пробирку воду по стенке из другой пробирки. Газоотводную трубку вынимают из воды, после этого прекращают нагревание и опыт заканчивается.
Уравнения реакций
– получение этилена: – взаимодействие с бромом:
H2SO4
СН3–СН2–ОН ® СН2 = СН2 + Н2О СН2 = СН2 + Br2 ® СН2Br – CH2Br (1,2- дибромэтан)
– взаимодействие с перманганатом калия:
3СН2=СН2+ 2KMnO4+ 4Н2О ® 3CH2(ОН)–CH2(ОН) + 2MnO2¯ + 2KOH
этиленгликоль
СН2=СН2+2KMnO4+3Н2SO4 ® HOOC–COОН+ K2SO4+ 2MnSO4+ 4H2O
щавелевая кислота
– горение этилена: - – образование сажи:
СН2 = СН2 + 3О2 ® 2 СО2 + 2 Н2О СН2 = СН2 + О2 → 2С+ 2Н2О
Опыт 2. Получение и свойства ацетилена.
Опыты с ацетиленом следует проводить под тягой, т.к. ацетилен, получаемый из карбида кальция, имеет неприятный запах и является ядовитым из-за наличия в нём различных примесей, особенно фосфористого водорода.
Реакции получения ацетилена и взаимодействия его с бромной водой, раствором перманганата калия, аммиачным раствором оксида серебра, аммиачным раствором хлорида меди (I) протекают быстро, поэтому в начале в пробирки наливают необходимые реактивы, только затем начинают эксперимент.
В первую пробирку наливают 3-4 мл бромной воды; во вторую – 1 мл раствора перманганата калия и 1 мл раствора соды; в третью – 3 мл аммиачного раствора оксида серебра; в четвертую – 3 мл аммиачного раствора хлорида меди(I).
В пробирку помещают 2-3 небольших кусочка карбида кальция CaC2, и приливают 1-2 мл воды. Пробирку сразу же закрывают пробкой с газоотводной трубкой с оттянутым концом, т.к. начинается выделение ацетилена. Выделяющийся ацетилен поджигают, отмечают характер пламени. В пламя вносят фарфоровую чашку или крышку от тигля, наблюдают, образуется ли черное пятно сажи.
Газоотводную трубку опускают в бромную воду в первой пробирке, наблюдают за признаками протекания химической реакции.
Аналогично ацетилен пропускают через подщелоченный раствор перманганата калия во второй пробирке, наблюдая за ходом реакции.
Далее ацетилен пропускают через аммиачные растворы в третьей и четвертой пробирках и наблюдают выпадение осадков ацетиленидов серебра и меди.
Образовавшийся осадок ацетиленида серебра отфильтровывают через складчатый фильтр и просушивают между листами фильтровальной бумаги. Затем осадок помещают на асбестовую сетку иил металлический шпатель и осторожно нагревают под тягой, надев защитные очки. Ацетиленид серебра разлагается со взрывом.
Остатки ацетиленида серебра уничтожают в соляной кислоте, разбавленной в соотношении 1: 4.
Уравнения реакций
– получение ацетилена: – горение ацетилена без подачи кислорода:
СаС2 + 2Н2O → СН ≡ СН↑ + Са(ОН)2 СН ≡ СН+ O2 → С + СО+ Н2O
– при интенсивной подаче кислорода ацетилен сгорает полностью:
2СН ≡ СН + 5O2 = 4СО2 + 2Н2O
– взаимодействие с бромной водой:
СН ≡ СН + 2Br2 ® СНBr2 – CHBr2 1,1,2,2 – тетрабромэтан
– взаимодействие с перманганатом калия:
3СН≡СН+ 8KMnO4+ 4Н2О® 3HOOC–COОН + 8MnO2¯ + 8KOH
щавелевая кислота
– получение ацетиленидов:
2[Аg (NН3)2]ОН + СН ≡ СН ® Аg – C ≡ C – Аg ↓ + 4NН3 + 2Н2О
2 [Cu(NН3)2]Сl + СН ≡ СН ® Cu – C ≡ C – Cu ↓ + 2NН4Сl+ 2NН3
– нагревание ацетиленида серебра:
t0
Аg – С ≡ С – Аg ® 2 С + 2Аg
– взаимодействие ацетиленида серебра с соляной кислотой:
Аg – С ≡ С – Аg + 2НСl ® СН ≡ СН + 2АgСl↓
Контрольные вопросы
1. Какие реакции называются качественными?
2. Что можно определить с помощью качественного анализа?
3. В чём отличие качественного анализа от количественного?
4. Какие реакции можно использовать для качественного анализа непредельных соединений?
5. Что такое бромная вода? Как можно изобразить её формулу?
6. Реакция галогенирования характерна как для алканов, так и для алкенов и алкинов. Они протекают по одному и тому же механизму? Напишите названия механизмов и уравнения реакций.
7. Лекарственный препарат «Линетол», получаемый из льняного масла, содержит смесь эфиров олеиновой, линолевой и линоленовой кислот. Произойдёт ли обесцвечивание бромной воды при её взаимодействии с водным раствором этого препарата? Ответ поясните. К какому типу можно отнести реакцию с бромной водой?
8. Привлекающим феромоном рабочей пчелы является первичный спирт гераниол. Установите строение молекул гераниола, если известны следующие его свойства: состав молекулы С10Н18О; при бромировании образует вещество 2,3,6,7-тетрабром-3,7-диметил-1-октанол.
9. В какой среде (нейтральной или кислой) окислительные свойства перманганата калия выражены сильнее?
10. Недавно ученые получили из спинномозговой жидкости кошек вещество, позволяющее им быстро засыпать. Оно так же действует и на человека. Это удивительно простое соединение: амид цис-9-октадеценовой кислоты. Напишите формулу соединения.
 2018-01-21
2018-01-21 2015
2015