1. Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через электролит электричества.
2. При электролизе различных химических соединений равные количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их эквивалентов.
Согласно этим законам:
1. m = Kэ Q или m = Kэ I t, где m – масса выделившегося вещества
Q – количество электричества в кулонах / Кл /
I - сила тока в амперах / А /
t - время в секундах / с /
Kэ - коэффициент пропорциональности, называемый электрохимическим эквивалентом
Если I = 1 A, t = 1 c и, следовательно Q = 1 Кл, то m = Kэ , т.е. электрохимический эквивалент – это масса вещества, выделившегося на электроде током силой в 1 А в течение 1 с или количеством вещества 1 Кл,
Kэ = 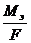 , тогда m =
, тогда m = 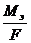 I t, а Мэ =
I t, а Мэ = 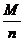 , где М- молярная масса вещества, а n – число электронов, перемещаемых при окислении или восстановлении
, где М- молярная масса вещества, а n – число электронов, перемещаемых при окислении или восстановлении
2. 96500 Кл или 26,8 А / ампер-час / выделяют на электродах молярную массу эквивалента данного вещества. Это количество электричества называют числом или постоянной Фарадея F / Кл/моль или А час/ моль /
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается меньше той, которая соответствует количеству прошедшего электричества. Отношение массы реально выделенного вещества на электроде к теоретической и умноженной на 100, называют выходом по току:
Вт =  100. Так как m = Kэ I t или m =
100. Так как m = Kэ I t или m = 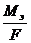 I t; Вт =
I t; Вт =  100%
100%
Пример 7.
Для водного раствора данного электролита:
- напишите уравнения процессов, которые идут на электродах при электролизе;
- рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока, равной I = …. A, в течение t часов и выходу по току Вт;
- определите, как изменится анодный процесс, если анод заменить на другой, указанный в таблице
| AgNO3 | рН=10 | графитовые | 0,85 | 0,5 | цинковые |
Решение:
Нитрат серебра диссоциирует: AgNO3 ↔ Ag+ + NO3-
- процессы, протекающие на электродах:
Катод (-) Ag+ + e- ® Ag0
Анод (+) выполнен из графита при рН=10 4 OH- - 4 e- ® O2 + 2 H2O
Анод (+) выполнен из цинка идет процесс растворения цинкового анода:
Zn - 2 e- ® Zn2+, таким образом при электролизе раствора нитрата серебра AgNO3, образуется Ag0, O2 и H2O.
- рассчитаем массу серебра и объем кислорода, образовавшихся при электролизе раствора AgNO3 при силе тока равной 15А, времени 0,5 часа с учетом выхода по току, равным 0,85.
Мэ Ag = 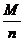 = 108 г/моль. Определяем массу серебра, которая бы выделилась теоретически при прохождении через раствор AgNO3 данного количества электричества, учитывая, что 0,5 часа равняется 1800 секундам.
= 108 г/моль. Определяем массу серебра, которая бы выделилась теоретически при прохождении через раствор AgNO3 данного количества электричества, учитывая, что 0,5 часа равняется 1800 секундам.
mAg = 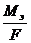 I t =
I t =  = 30,2(г), так как Вт = 0,85,
= 30,2(г), так как Вт = 0,85,
то mAg = 30,2 х 0,85 = 25,67 (г).
Определяем объем кислорода, который бы выделился теоретически при прохождении через раствор AgNO3 данного количества электричества, учитывая, что 0,5 часа равняется 1800 секундам, при силе тока, равной 15А.
VO2 =  I t =
I t =  = 1,56(л), так как Вт = 0,85,
= 1,56(л), так как Вт = 0,85,
то VO2 = 1,56 х 0,85 = 1,32 (л).
 2018-01-21
2018-01-21 428
428








