Министерство образования Российской Федерации
Новгородский Государственный университет им. Ярослава Мудрого
Кафедра фундаментальной и прикладной химии
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Великий Новгород
2012г.
СОДЕРЖАНИЕ
| 1. | Оксиды | |
| 2. | Гидроксиды | |
| 2.1. | Основания | |
| 2.2. | Кислоты | |
| 3. | Соли | |
| 3.1. | Средние соли | |
| 3.2. | Кислые соли | |
| 3.3. | Основные соли | |
| 3.4. | Двойные и смешанные соли | |
| 4. | Галогенангидриды | |
| Литература |
Неорганические соединения можно классифицировать по составу и свойствам.
Способ классификации по составу предполагает разделение соединений на двухэлементные (бинарные) и многоэлементные (тринарные, тетрарные и т.д.). Оксиды, галогениды, например, являются бинарными соединениями, гидроксиды – тринарными.
Большее значение для химии имеет классификация неорганических соединений по свойствам (функциональным признакам). При таком способе классификации выделяют следующие классы соединений: оксиды, основания, амфотерные гидроксиды, кислоты, соли. Обычно основания, амфотерные гидроксиды и кислородсодержащие кислоты ввиду сходства их составов объединяют в класс гидроксидов.
ОКСИДЫ
Оксиды – это бинарные соединения элементов с кислородом, в которых он имеет степень окисления –2. Из этого определения следует, что большая группа соединений, включающая пероксид водорода и его производные, к оксидам не относится.
В зависимости от степени окисления элемента (Э) формулы оксидов имеют следующий вид:
+1Э2О, +2ЭО, +3Э2О3, +4ЭО2, +5Э2О5, +6ЭО3, +7Э2О7, +8ЭО4,
а их графические формулы соответственно имеют вид:
Э – О – Э Э = О О = Э – О – Э = О О = Э = О 
| О | О | О | О | О | О | О | ||||||||||||||||||
| || | || | \\ // | || | || | || | |||||||||||||||||||
| Э | ¾ | О | ¾ | Э | Э | О | = | Э | ¾ | О | ¾ | Э | = | О | О | = | Э | = | О | |||||
| || | || | || | || | || | || | |||||||||||||||||||
| О | О | О | О | О | О | |||||||||||||||||||
Как видно из графических формул, в молекулах оксидов атомы кислорода связаны с атомами элемента и не связаны, как и последние, друг с другом.
По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие. Последних немного (CO, NO, N2O, SiO). Эти соединения не обладают способностью реагировать с основаниями, кислотами, другими оксидами с образованием солей.
Солеобразующие оксиды, в свою очередь, подразделяются на основные (реагируют с кислотами, образуя соли, и не реагируют с основаниями), кислотные (реагируют с основаниями, давая соли, и не реагируют с кислотами) и амфотерные (реагируют как с кислотами, так и с основаниями). Амфотерные оксиды, таким образом, в зависимости от свойств реагента – партнера могут выступать в роли и основных, и кислотных оксидов.
В группу основных входят оксиды металлов, причем обычно одно- и двухвалентных (Na2O, Cu2O, MgO, FeO, MnO, Bi2O3 и др.), в группу амфотерных – оксиды металлов, чаще трехвалентных, реже – двух- и многовалентных (ZnO, PbO, Al2O3, Cr2O3, Sb2O3, TiO2, MnO2 и др.). Кислотными являются оксиды неметаллов (кроме нескольких, несолеобразующих), а также оксиды металлов, в которых металлы проявляют высокую степень окисления: Cl2O, B2O3, CO2, P2O5, Sb2O5, SO3, Cl2O7, CrO3, Mn2O7, XeO4.
Таким образом, для оксидов металлов наблюдается следующая закономерность: чем выше степень окисления металла, тем более вероятней проявление его оксидом кислотных свойств, и наоборот, чем ниже степень окисления, тем скорее следует ожидать от оксида основных свойств. При промежуточных значениях степени окисления металлов соответствующие оксиды обнаруживают часто те, и другие свойства, то есть оказываются амфотерными.
Существует также связь свойств оксидов с положением элементов в периодической системе. Наиболее ярко она проявляется для высших оксидов. Неметаллический характер, степень ковалентности связи элемент – кислород, а значит, кислотные свойства оксидов нарастают в периодической системе слева направо и снизу вверх. В противоположных направлениях усиливается металлический характер элементов, увеличивается степень ионности связи элемент – кислород и сильнее проявляются основные свойства оксидов, усиливается неметаллический характер элементов, увеличивается степень ковалентности.
При комнатной температуре большинство оксидов – твердые вещества (СuO, Fe2O3 и др.), некоторые – жидкости (H2O, Cl2O7 и др.) и газы (NO, SO2 и др.). Химическая связь в оксидах – ионная (оксиды щелочных и щелочноземельных металлов), либо ковалентная (CO2, B2O3, Ag2O, CuO).
Номенклатура оксидов
Если элемент, образующий оксид, имеет единственную степень окисления, то ее в названии оксида можно не указывать: Na2O – оксид натрия. Если же элемент образует несколько оксидов, то это необходимо: MnO – оксид марганца (II), MnO2 – оксид марганца (IV), Mn2O7 – оксид марганца (VII). По реже используемой в неорганической химии систематической номенклатуре, требующей полного отражения состава соединений, оксиды называются так: CrO – хром оксид, Cr2O3 – дихром триоксид.
Химические свойства оксидов
Кислотные оксиды образуют гидратные формы, которые имеют характер кислот, образующихся при непосредственном взаимодействии оксидов с водой, либо косвенным путем. Кислотные оксиды являются ангидридами кислородсодержащих кислот. Такие оксиды, как SO2, SO3, N2O3, P2O5 и другие образуют кислоты при прямом взаимодействии с водой:
SO3+H2O®H2SO4,
N2O5+H2O®2HNO3.
В ряде случаев кислотные оксиды практически не реагируют с водой (например, SiO2) или реагируют весьма незначительно (например, WO3 и MoO3). Гидратные формы этих оксидов образуются косвенным путем, то есть сначала их переводят в соли путем взаимодействия со щелочами:
SiO2+2NaOH®Na2SiO3+H2O,
WO3+2NaOH®Na2WO4+H2O,
а полученные соли разлагают растворами более сильных кислот:
Na2SiO3+2HCl®2NaCl+H2SiO3¯,
Na2WO4+H2SO4®Na2SO4+H2WO4¯.
Кислотные оксиды, которые при взаимодействии с водой образуют две кислоты, называются смешанными ангидридами. К числу таких ангидридов относятся: оксид азота (IV), оксид хлора (IV) и некоторые другие; в них центральные атомы имеют необычные для данного элемента степени окисления. Так при растворении NO2 в холодной воде образуются азотная и азотистая кислоты:
2NO2+H2O®HNO3+HNO2,
а при растворении ClO2 образуются хлорноватая и хлористая кислоты:
2ClO2+H2O®HClO3+HClO2.
Существует также группа так называемых сложных оксидов. В их состав входят атомы элементов в различных степенях окисления: Fe3O4 (FeO × Fe2O3), Pb3O4 (2PbO × PbO2), SbO2 (Sb2O3 × Sb2O5).
Поведение этих соединений в реакциях подобно поведению смесей соответствующих простых оксидов:
Fe3O4+8HCl®FeCl2+2FeCl3+4H2O,
Pb3O4+4HNO3®2Pb(NO3)2+PbO2+2H2O,
2SbO2+2NaOH®NaSbO2+NaSbO3+H2O.
Все кислотные оксиды реагируют с основными и амфотерными оксидами, с основаниями, образуя соли.
CO2+CaO®CaCO3,
SO3+ZnO→ZnSO4,
SO2+2NaOH®Na2SO3+H2O
Основными называются оксиды, способные к солеобразованию с кислотами и ангидридами кислот.
Основные оксиды образуют гидратные формы, имеющие характер оснований; последние образуются либо при непосредственном взаимодействии основных оксидов с водой, либо косвенным путем. По первому способу образуются щелочи, например,
K2O+H2O®2KOH,
BaO+H2O®Ba(OH)2.
В подавляющем большинстве случаев гидратные формы, имеющие характер оснований, получаются из оксидов косвенным путем. Примером могут служить: гидроксид меди (II) – Cu(OH)2, гидроксид висмута – Bi(OH)3, гидроксид железа (II) – Fe(OH)2 и многие другие. Для их получения следует прибегнуть к предварительному превращению данного оксида в соль, например:
CuO+H2SO4®CuSO4+H2O,
Bi2O3+3H2SO4®Bi2(SO4)3+3H2O,
а затем действовать на полученную соль щелочью, в результате чего образуется малорастворимый гидроксид металла:
CuSO4+NaOH®Cu(OH)2↓+Na2SO4,
Bi2(SO4)3+6KOH®2Bi(OH)3↓+3K2SO4.
Все основные оксиды при реакции с кислотными оксидами или кислотами образуют соли:
CuO+SO3→CuSO4,
MgO+2HCl®MgCl2+H2O
Амфотерным оксидам соответствуют амфотерные гидроксиды:
ZnO®Zn(OH)2ºH2ZnO2,
Al2O3®Al(OH)3ºH3AlO3®HAlO2+H2O
Амфотерные оксиды и их гидратные формы (амфотерные гидроксиды) являются соединениями двойственной функции. Особенностью их химического поведения является способность к солеобразованию как с кислотами, так и с основаниями.
Амфотерные оксиды образуют соли:
1) при взаимодействии с сильными кислотами (как основные оксиды):
Al2O3+6HNO3®2Al(NO3)3+3H2O;
2) при реакции со щелочами (как кислотные оксиды):
Al2O3+2NaOH®2NaAlO2+H2O (в расплаве),
Al2O3+6NaOH+3H2O®2Na3[Al(OH)6] (в растворе);
3) при нагревании с кислотными или основными оксидами:
ZnO+SO3®ZnSO4,
ZnO+Na2O®Na2ZnO2;
4) амфотерные гидроксиды в воде не растворяются.
Получение оксидов
1) окисление простых веществ:
S+O2®SO2,
2Сu+O2®2CuO;
2) разложение сложных веществ:
а) дегидратация кислородсодержащих кислот:
H2CO3«CO2↑+H2O,
H2SiO3®SiO2+H2O;
б) дегидратация нерастворимых оснований при нагревании:
Сu(OH)2®CuO+H2O;
в) термическое разложение некоторых солей:
CaCO3®CaO+CO2↑,
2Cu(NO3)2®2CuO+4NO2↑+O2↑;
3) горение органических соединений:
CH4+2O2®CO2+2H2O;
4) горение летучих водородных соединений (кроме галогеноводородов):
2H2S+3O2®2SO2+2H2O,
4NH3+5O2®4NO+6H2О;
5) обжиг сульфидов тяжелых металлов:
2CuS+3O2®2CuO+2SO2,
4FeS2+11O2®2Fe2O3+8SO2;
6) окисление и восстановление оксидов:
2CO+O2®2CO2,
6FeO+O2®2Fe3O4,
CO2+C ®2CO;
7) взаимодействие H2SO4(конц.) и HNO3 с металлами:
Cu+2H2SO4(конц.)®CuSO4+SO2↑+2H2O,
Pb+4HNO3(конц.)→Pb(NO3)2+2NO2↑+2H2O,
3Ag+4HNO3(разб.)®3AgNO3+NO↑+2H2O.
ГИДРОКСИДЫ
Гидратные формы оксидов называются гидроксидами. Обычно различают ортоформы, метаформы и пироформы (диформы). В ортоформах число групп ОН- отвечает степени окисления центрального атома. Так, ортогидратная форма оксида алюминия имеет состав Al(OH)3, а оксида кремния (IV) - Si(OH)4 или H4SiO4.Однако иногда, как исключение, ортоформами называют соединения, имеющие иной состав. К ним относятся, например, H3PO4 – ортофосфорная кислота и H3AsO4 – ортомышьяковая кислота.
Метаформы содержат минимальное возможное число ОН-групп, например, AlO(OH) или HАlO2, SiO(OH)2 или H2SiO3, PO2(OH) или HPO3. Пироформы (диформы) содержат в своем составе два центральных атома и нечетное число атомов кислорода, например, H2S2O7, H4P2O7, H2Si2O5 (в их названиях сейчас чаще используют приставку ди-: дисерная, дифосфорная, дикремниевая).
При написании графической формулы гидроксида следует исходить из того, что она состоит из центрального атома – металла или неметалла, соединенного с гидроксогруппами –ОН и с атомами кислорода: =О. В подавляющем большинстве случаев ионы Н+ сочетаются с центральным атомом через кислород, и, следовательно, по их числу можно судить о числе ОН-групп, окружающих центральный атом или ион. Так, например, графические формулы Al(OH)3 и H4SiO4 имеют следующий вид:
| О-Н | Н-O | O-Н | ||||||||||||||||||
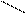 | 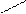 | |||||||||||||||||||
| H-O | — | Al | Si | |||||||||||||||||
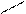 | 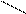 | |||||||||||||||||||
| О-Н | Н-О | O-Н |
Если число атомов кислорода больше числа атомов водорода, то это означает, что избыточные атомы кислорода также соединяются с центральным атомом, который «расходует» при этом две связи на каждый атом кислорода. Так, графические формулы HNO3, H2SO4 и H3PO4 имеют вид:
| O | Н-O | O | Н-О | ||||||||||||||||||||
| // |  | // | |||||||||||||||||||||
| Н-O | — | N |  | S | Н-O | — | P | ═ | O | ||||||||||||||
| \\ | \\ | ||||||||||||||||||||||
| O | Н-О | O | Н-О | ||||||||||||||||||||
Когда в состав молекулы входят два центральных атома элемента, образующего гидратную форму, то при нечетном числе атомов кислорода оба атома элемента соединяются друг с другом общим кислородным атомом, а ОН-группы и остальные атомы кислорода в большинстве случаев располагаются симметрично относительно обоих центральных атомов элемента. В качестве примера приведем графические формулы дисерной H2S2O7 и дифосфорной H4P2O7 кислот:
| Н-O | О | O | О-Н | Н-О | O-Н | ||||||||||||||||||||
| || | || | ||||||||||||||||||||||||
| S | — | О | — | S | P | — | O | — | P | ||||||||||||||||
| || | || | || | || | ||||||||||||||||||||||
| O | O | Н-O | O | O | O-Н |
По химическим свойствам гидроксиды делятся на три группы – основные (основания), кислотные (кислоты) и амфотерные.
ОСНОВАНИЯ
Основания – сложные вещества, молекулы которых состоят из атома металла (или иона NH4+) и одной или нескольких гидроксогрупп, способных замещаться на кислотный остаток. Общая формула оснований Me(OH)х, где х равно степени окисления металла. Все основные гидроксиды находятся в орто-форме. При наименовании оснований для элементов, проявляющих переменную степень окисления, следует указать ее величину: Fe(OH)3 – гидроксид железа (III).
Классифицировать основания можно следующим образом:
1) по растворимости в воде основания делятся на растворимые (щелочи и NH4OH) и нерастворимые (все остальные основания);
2) по степени диссоциации основания подразделяются на сильные (щелочи) и слабые (все остальные).
3) по кислотности, то есть по числу гидроксогрупп, способных замещаться на кислотные остатки: на однокислотные (NaOH), двухкислотные [Ca(OH)2], трехкислотные [Al(OH)3].
 2017-11-01
2017-11-01 1839
1839