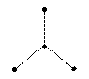
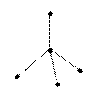
| |||||||||||||||||||||||||
Электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Чем сильнее межэлектронное отталкивание, тем больше условная поверхность на сфере, занимаемый электронной парой. Для качественного объяснения экспериментальных фактов обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательности периферийных атомов (метод Гиллеспи) - основные положения теории, объясняющей и предсказывающей геометрические конфигурации молекул на основе принципа Паули и модели отталкивания электронных пар валентной оболочки атомов.
Например, атом бериллия в основном состоянии не имеет неспаренных электронов. Однако в соединениях он проявляет валентность, равную двум. Это объясняется тем, что, вступая в химическое соединение атом бериллия переходит в возбужденное состояние (Ве*).
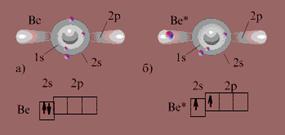
Атом бериллия а) в нормальном состоянии; б) в возбужденном состоянии
Таким образом, хотя на возбуждение атома бериллия затрачивается энергия, при образовании двух химических связей выделяется энергии гораздо больше, чем затрачивается. В результате система понижает свою энергию, то есть она становится устойчивее.
Образование молекулы BeH2 с учетом гибридизации атомных орбиталей

s -орбиталь + p -орбиталь дают две sp -гибридных орбитали
sp2 – треугольной (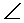 1200)
1200)
Образование молекулы BCl3 с учетом гибридизации атомных орбиталей
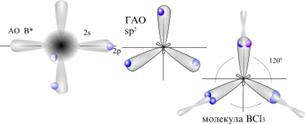
s -орбиталь + 2 p -орбитали дают три sp -гибридных орбитали
sp3 - тетраэдрической ( 109029′) гибридизацией
109029′) гибридизацией
Образование молекулы CH4 c учетом гибридизации атомных орбиталей
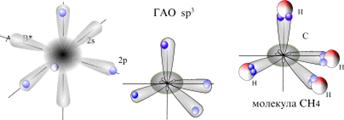
s -орбиталь + 3 p -орбитали дают четыре sp -гибридных орбитали
В молекуле CH4 гибридные орбитали из четырех АО углерода (одной s и трех p), называются sp3-орбиталями, они полностью эквивалентны энергетически и пространственно направлены к вершинам тетраэдра.
Имеются и другие типы гибридизации: sp3d2 - октаэдрическая ( 900), sp3d - треугольнобипирамидальная (900 и 1200), sp2d - квадратная (
900), sp3d - треугольнобипирамидальная (900 и 1200), sp2d - квадратная ( 900 и 1800) и другие.
900 и 1800) и другие.
Для изображения геометрической конфигурации орбиталей в пространстве необходимо помнить о кратных связях в молекулах. Ординарная связь образуется одной электронной парой, причем электронная плотность в основном сосредоточена между атомами на оси связи (сигма-связь). Вторая связь, образованная второй электронной парой, должна располагаться вне линии связи, так как понятие орбиталь включает в себя и пространство, в котором движется электрон, а благодаря принципу исключения Паули на ней не может быть более 2-х электронов с противоположными спинами (пи-связь). Очевидно, что количество связей между двумя атомами не может быть большими 3-х.
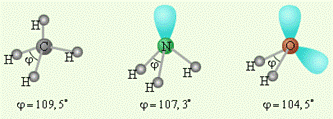
Рассмотрим те элементы Периодической таблицы, у которых оболочки, имеющие d -орбитали, либо целиком заполнены, либо совсем свободны. В качестве примера рассмотрим молекулы NH3 и H2O (совсем свободны). Атомы азота и кислорода склонны к sp3-гибридизации. У азота на sp3-ГО, помимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая пара. Именно она, занимая одну sp3-ГО, искажает угол связи H–N–H до 107,3°. В молекуле H2O таких несвязывающих пар две, и угол H–O–H равен 104,5°.
Все изложенное выше предполагает, что атомы могут образовывать столько ковалентных связей, сколько орбиталей у них занято одним электроном, однако так бывает не всегда. Атом углерода в основном состоянии имеет электронную конфигурацию (1 s)2(2 s)2(2 p x)(2 p y), при этом две орбитали не заполнены, т.е. содержат по одному электрону. Однако соединения двухвалентного углерода встречаются очень редко. Обычно углерод четырехвалентен, и связано это с тем, что для его перехода в возбужденное s - состояние (1 s)2(2 s) (2 p x)(2 p y)(2 p z) с четырьмя незаполненными орбиталями нужно совсем немного энергии. Энергетические затраты, связанные с переходом 2 s -электрона на свободную 2 р -орбиталь, с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных связей. Для образования незаполненных АО необходимо, чтобы этот процесс был энергетически выгодным. Атом азота с электронной конфигурацией (1 s)2(2 s)2(2 p x)(2 p y)(2 p z) не образует пятивалентных соединений, поскольку энергия, необходимая для перевода 2 s -электрона на 3 d -орбиталь с образованием пятивалентной конфигурации (1 s)2(2 s)(2 p x)(2 p y)(2 p z)(3 d), слишком велика.
Взаимодействие атомов с образованием связи между ними происходит только при наличии орбиталей с близкими энергиями, т.е. орбиталей с одинаковым главным квантовым числом.
Связи с участием d-орбиталей. В отличие от азота атом фосфора может образовывать пять ковалентных связей. В основном состоянии фосфор имеет конфигурацию (1 s)2(2 s)2(2 p)6(3 s)2(3 p x)(3 p y)(3 p z) и является трехвалентным. Известны соединения и пятивалентного фосфора типа PF5, где фосфор находится в валентном состоянии +5, согласующемся с электронной конфигурацией (1 s)2(2 s)2(2 p)6(3 s)(3 p x)(3 p y)(3 p z)(3 d); связи с этом случае образуются в результате sp 3 d -гибридизации (т.е. в результате смешивания одной s -, трех р - и одной d -АО). Оптимальной структурой с точки зрения уменьшения взаимного отталкивания пар валентных электронов является треугольная бипирамида (см. таблицу).
Электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Для качественного объяснения экспериментальных фактов обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательности периферийных атомов (метод Гиллеспи).
 2014-01-27
2014-01-27 951
951