Озон О3 – аллотропическая модификация кислорода, отличающаяся высокой токсичностью и высокой окислительной активностью. Его присутствие в воздухе тропосферы даже в сравнительно небольших количествах представляет опасность для всего живого.
Важной особенностью озона является его способность поглощать солнечное излучение:
О3 + hν → О2 + О (1D) λ (8)
Озон разрушается, поглощая излучение с длинной волны меньше 1130 нм (ИК-излучение), но максимум поглощения наблюдается при длине волны короче 310 нм (УФ-излучение). Озон поглощает УФ-излучение в тысячи раз лучше, чем кислород, и количества озона в стратосфере, где концентрация его достигает максимальных значений, в десятки и сотни раз превышающих среднее его содержание в тропосфере, достаточно для практически полного поглощения жесткого УФ-излучения Солнца. Поэтому озон стратосферы выполняет защитную функцию, и уменьшение его количества в этой области атмосферы может представлять опасность для биоты и прежде всего для человека.
Зона с максимальными значениями концентрации озона находится на высоте от 15 до 35 км (рис. 15).
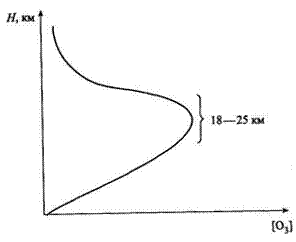
Рис. 15 – Изменение концентрации озона в атмосфере по высоте
На больших высотах концентрация озона резко снижается, и на высоте более 85 км О3 практически отсутствует. Поэтому озон мезосферы хотя и поглощает УФ-излучение, однако вносит лишь небольшой вклад в защиту биосферы от солнечного излучения в УФ-области. Озон мезосферы играет важную роль в поддержании теплового баланса планеты и формировании нижнего слоя ионосферы.
В начальные периоды изучения озонового слоя планеты (в 20-х годах прошлого столетия) основным прибором для измерения содержания озона в атмосфере был спектрометр Добсона. Этот прибор позволял достаточно надежно определять общее количество озона, находящегося в столбе воздуха над наблюдателем. Полученные значения суммарного объема озона в столбе атмосферы единичной площади сечения приводили к нормальным условиям и определяли высоту, которая приходится в этом столбе атмосферы на весь озон. Слой озона высотой 10-5 м принимается равным одной единице Добсона (е.Д.). Общее количество озона в атмосфере меняется от 120 до 760 е.Д. при среднем для всего земного шара значении 290 е.Д.
Таким образом, весь озон, собранный из атмосферы к поверхности Земли, мог бы покрыть ее слоем, толщина которого в среднем составила бы 2,9 мм. Ошибочная трактовка данного способа выражения общего содержания О3 в атмосфере привела к формированию в массовом сознании понятие озонового слоя, или тонкого озонового экрана, якобы существующего в атмосфере. В реальных условиях весь озон неравномерно распределен в слое воздуха от поверхности Земли практически до верхней границы мезосферы. Характер этого распределения связан с процессами образования и гибели озона (рис.15), зависит от времени года и географической широты местности.
В целом в атмосфере по характеру сезонных колебаний и высотному профилю концентраций озона выделяют три зоны:
1) полярная зона – характеризуется наибольшими значениями среднего общего содержания (около 400 е.Д.) и концентраций озона, наибольшими сезонными колебаниями (около 50%), зона максимальной концентрации О3 расположена наиболее близко к поверхности – на высотах 13-15 км, концентрация О3 в этой зоне – (4-5)1012 молек./см3.
2) тропическая зона – среднегодовые значения общего содержания озона невелики и составляют примерно 265 е.Д., сезонные колебания не превышают 10-15%, зона максимальной концентрации О3 находится на высотах 24-27 км, концентрация О3 в этой зоне составляет (1-2)·1012 молек./см3.
3) средние широты – занимают промежуточное положение; сезонное изменение составляет 30-40% от средних значений, зона максимальной концентрации О3 находится на высоте 19-20 км, концентрация озона в этой зоне достигает 3·1012 молек./см3.
Нулевой цикл
При взаимодействии с излучением длинной волны
О2 + hν → О (1D) + О (3Р)
Лишь атом, находящийся в основном состоянии, способен вступить в реакцию синтеза озона. Этот процесс может быть представлен следующим уравнением:
О2 + О (3Р) + М → О3 + М
В качестве третьего тела М могут выступать молекулы О2 или N2, которых больше, чем других газов.
Участие возбужденных атомов кислорода в реакции не приводит к синтезу озона, поскольку в этом случае даже перераспределением энергии при участии третьего тела не удается стабилизировать молекулу О3.
Молекула О3 может взаимодействовать с атомом кислорода с образованием 2-х молекул кислорода:
О3 + О → 2О2
Эта реакция приводит к стоку О3 из стратосферы. Однако ее скорость значительно ниже, чем скорость реакции образования озона, поэтому ее вклад в процессы вывода О3 из атмосферы незначителен. Основное количество озона в атмосфере разлагается в результате поглощения излучения по реакции:
О3 + hν → О2 + О (1D) или
О3 + hν → О2 + О (3Р)
Образование атома кислорода в основном или возбужденном состоянии определяется энергией поглощенного кванта.
Атом кислорода О (3Р) может вновь принять участие в синтезе озона.
Реакции образования и разложения озона называют нулевым циклом озона.
Значительный вклад в процесс разрушения озона вносят цепные процессы, протекающие с участием гидроксильных радикалов (водородный цикл), оксидов азота (азотный цикл), соединений хлора и брома (хлорный и бромный циклы). Рассмотрим более подробно каждый из этих циклов.
Водородный цикл
Гидроксильные радикалы образуются при фотодиссоциации воды
Н2О + hν → Н + ОН λ
Гидроксильные радикалы образуются и при взаимодействии молекул воды или метана с возбужденным атомом кислорода О (1D):
О (1D) + Н2О → 2 ОН
О (1D) + СН4 → СН3 + ОН
Образовавшийся гидроксильный радикал может вступить в реакцию с озоном:
ОН + О3 → НО2 + О2
НО2 + О → ОН + О2
О3 + О → 2О2
Водородный цикл, брутто-уравнение которого идентично реакции, входящей в нулевой цикл, замыкается, но при этом полностью нарушается нулевой цикл озона.
Азотный цикл
Оксид азота при взаимодействии с озоном окисляется до NO2, но при взаимодействии NO2 с атомарным кислородом в возбужденном состоянии вновь образуется NO. Азотный цикл замыкается, но при этом нарушается нулевой цикл озона:
NO + O3 → NO2 + O2
NO2 + O → NO + O2
О3 + О → 2О2
Необходимо отметить, что опасность для озонового слоя представляют только образующиеся непосредственно в стратосфере NO и NO2. NO и NO2, образующиеся в воздухе тропосферы, имеют малое время жизни и не успевают достигнуть стратосферы. Среди оксидов азота, образующихся на поверхности Земли, опасность для озонового слоя представляет лишь имеющий достаточно большое время жизни и поэтому способный преодолеть глобальный инверсионный барьер и достичь зоны максимальной концентрации О3 оксидазота (I) N2O. Этот газ способен превращаться в оксид азота, инициирующий азотный цикл гибели озона:
N2O + O (1D) → 2NO
Хлорный цикл
Атом хлора при взаимодействии с О3 образует оксид хлора ClO и молекулу О2. ClO взаимодействует с О (3Р) c образованием молекулы кислорода и атомарного хлора:
Cl + O3 → ClO + O2
ClO + O (3P) → Cl + O2
O3 + O → 2O2
Хлорный цикл замыкается, а нулевой цикл озона нарушается.
Атомарный хлор появляется в стратосфере при фотохимическом разложении ряда хлорфторуглеводородов, которые благодаря малой химической активности и большому времени жизни успевают достигнуть зоны максимального содержания О3 в стратосфере. Наибольшую опасность среди хлорфторуглеводородов (ХФУ) представляют некоторые их фреонов. Эти нетоксичные, пожаро-взрывобезопасные соединения, обладающие низкой реакционной способностью, широко использовались в холодильной технике, при производстве пенопластов и каучука, в изготовлении различных бытовых товаров в аэрозольных упаковках. Попадая в стратосферу, эти соединения могут взаимодействовать с излучением с λ
CFCl3 + hλ → CFCl2 + Cl, и может начаться разрушение озонового слоя.
Бромный цикл
Атом брома подобно атому хлора способен при взаимодействии с О3 образовывать оксид брома и молекулу О2. Однако в отличие от ClO оксид брома BrO может вступить в реакцию с другой молекулой BrO или с ClO, при этом образуются два атома соответствующего галогена и молекула кислорода:
Br + O3 → BrO + O2
BrO + BrO → 2Br + O2
BrO + ClO → Br + Cl + O2
Во всех рассмотренных до этого циклах нарушения озонового слоя реакция с участием атомарного кислорода является наиболее медленной, и ее скорость лимитирует соответствующие циклы. В случае бромного цикла процесс значительно ускоряется, и бром потенциально более опасен для озонового слоя, однако влияние этого цикла на озоновый слой в настоящее время меньше, чем влияние других рассмотренных циклов.
Это связано с меньшими концентрациями брома в атмосфере. Основными источниками брома в стратосфере являются бромсодержащие органические соединения, используемые для тушения пожаров (галлоны). Эти соединения, как и фреоны, устойчивы в тропосфере, имеют большое время жизни, и попадая в стратосферу, разлагаются под действием жесткого УФ-излучения. Образующийся при этом атом брома может вступать во взаимодействие с молекулой озона.
 2014-01-31
2014-01-31 2438
2438








