Связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Но в молекуле ацетилена в каждом из атомов углерода содержится еще по два р -электрона, которые не принимают участия в образовании σ -связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р -электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. В итоге, в молекуле ацетилена образуются еще две ковалентные С–С связи, называемые π-связями.
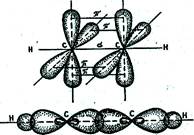
σ-связи являются более прочными, чем π -связи, чем объясняется большая реакционная способность непредельных углеводородов по сравнению с предельными.
Еще один вид гибридизации s- и р -орбиталей осуществляется в соединениях бора, алюминия или углерода (этилен, бензол). Возбужденный атом бора имеет три неспаренные электрона – один s - и два р -электрона. В этом случае при образовании соединений происходит sp2-гибридизация, при этом образуются три одинаковые sp2 -гибридные орби-тали, расположенные под углом 120° друг к другу. Так, соединения ВF3, АlСl3, а также этилен и бензол имеют плоское строение, и все три связи В–F, например, в молекуле ВF3 расположены под углом 120° друг к другу.
Посредством образования sp2 -гибридных орбиталей объясняются структуры непредельных углеводородов с двойными связями. Так, для молекулы этилена схематично можно изобразить следующую структуру.
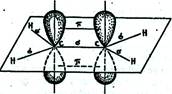
Двойные углерод–углеродные связи состоят из одной σ- и одной π-связи.
Энергия связи – энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100-800 кДж/моль.
Метод молекулярных орбиталей (ММО) – наиболее универсальный методом описания химической связи, в нем описывается состояние электрона в многоатомной системе, рассматривая молекулу как «многоядерный атом» в котором электроны заселяются по молекулярным орбиталям (рис.).
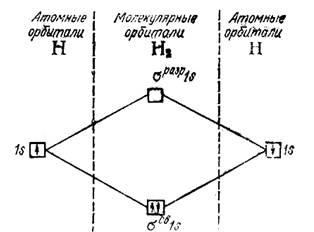
| Рис. Энергетическая схема образования молекулы водорода |
 2014-01-31
2014-01-31 718
718








