Карбоновые кислоты – более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы –СО. В водном растворе карбоновые кислоты диссоциируют:
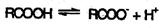
Тем не менее, из-за ковалентного характера молекул карбоновых кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево. Таким образом, - карбоновые кислоты – это, как правило, слабые кислоты. Например, уксусная кислота характеризуется константой диссоциации Ка = 1,7*10-5.
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индуктивного эффекта. Такие заместители, как хлор или фенильный радикал, оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индуктивный эффект (–I). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие заместители, как алкильные группы, обладают электронодонорными свойствами и создают положительный индуктивный эффект (+I). Они понижают кислотность.
Взаимное влияние атомов в молекулах дикарбоновых кислот приводит к тому, что они являются более сильными, чем одноосновные.
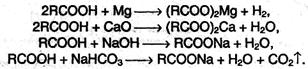
1. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
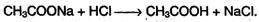
Соли карбоновых кислот в водных растворах гидролизованы:
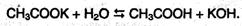
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
2. Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R–CO–X; здесь R обозначает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу (R–CN), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот.
Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
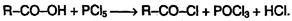
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств:
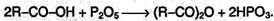
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
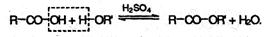
Механизм реакции этерификации установлен методом «меченых атомов».
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:

Кроме того, амиды могут быть получены при нагревании аммонийных солей карбоновых кислот:
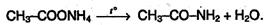
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
При нагревании амидов в присутствии водоотнимающих средств они дегидратируются с образованием нитрилов:
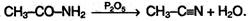
Функциональные производные низших кислот – летучие жидкости (за исключением амидов, которые при обычных условиях – твердые вещества). Все они гидролизуются с образованием исходной кислоты:
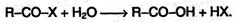
В кислой среде эти реакции могут быть обратимы. Гидролиз в щелочной среде необратим и приводит к образованию солей карбоновых кислот, так:
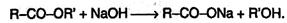
3. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода (α-атоме):
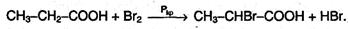
Непредельные карбоновые кислоты способны к реакциям присоединения:
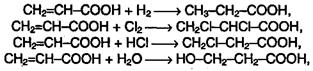
Две последние реакции протекают против правила Марковникова,
Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации:
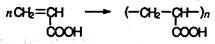
4. Окислительно-восстановительные реакции карбоновых кислот.
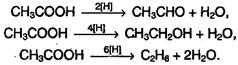
Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды:
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
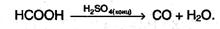
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
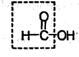
Муравьиная кислота – сильный восстановитель и легко окисляется до СО2. Она дает реакцию «серебряного зеркала»:
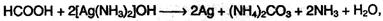
или в упрощенном виде:
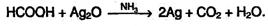
Кроме того, муравьиная кислота окисляется хлором
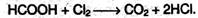
В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:
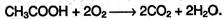
5. Реакции декарбоксилирования. Насыщенные незамещенные монокарбоновые кислоты из-за большой прочности связи С-С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление соли щелочного металла карбоновой кислоты со щелочью:
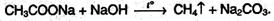
Появление электронодонорных заместителей в углеводородном радикале способствует реакции декарбоксилирования:
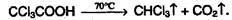
Двухосновные карбоновые кислоты легко отщепляют СО2 при нагревании:
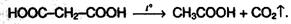
 2014-01-31
2014-01-31 1107
1107