Лекция № 8
Электронная схема жизни. Схема энергообеспечения жизнедеятельности животных и человека складывается из двух процессов: фотосинтеза и клеточного дыхания, которое обеспечивают кругооборот электронов в биосфере, и поэтому называется электронной схемой жизни.
Транспорт возбужденных π -электронов, обеспечивающий аккумулирование (конвертирование) солнечной энергии в макроэргических связях АТФ, свойствен хлорофиллсодержащим бактериям и зеленым растениям.
Хлорофилл обладает уникальной способностью быть как донором, так и акцептором электронов в зависимости от действия на него солнечного света.
В исходном состоянии (когда на него не действует свет) хлорофилл служит донором электронов. Поглотив фотон, этот пигмент теряет электрон, окисляется и приобретает акцепторные свойства. Принимая электрон от сопряженных с ним веществ, он снова испытывает восстановление и становится готовым отдать электроны, если на него вновь подействует свет. Такая цикличность в работе хлорофилла позволяет называть его «электронным насосом», приводимым в действие и регулируемым солнечной энергией. Это важнейшее свойство замечательного пигмента открыто в 1948 г. академиком А.А. Красновским. Его открытие вошло в науку под названием реакции обратимого фотохимического восстановления хлорофилла (реакции Красновского).
Фотосинтез у хлорофиллсодержащих бактерий. У хлорофиллсодержащих бактерий хлорофилл сосредоточен в плазмолемме. Там же присутствуют и другие вещества, участвующие в переносе электронов, которые возбуждаются солнечной энергией в молекуле хлорофилла и покидают ее.
Мембрана обеспечивает тесное взаимодействие всех компонентов фотосинтетического комплекса. Благодаря его упорядоченной мембранной организации промежутки между соседними компонентами этого комплекса не превышают порядка 1 нм, что обеспечивает миграцию возбужденных π -электронов между молекулами по резонансному механизму.
Фотон, поглощаясь молекулой хлорофилла, возбуждает в ней электрон, который переносится на феофитин, а с него − на убихинон и далее − на цитохром с. Убихинон сосредоточен на внутренней стороне плазмолеммы, а цитохром с − на наружной. Расстояние между ними более 2,5 нм. Чтобы передать электрон цитохрому с, убихинон должен пересечь плазмолемму. Для этого он превращается в убихинол, присоединив вместе с парой электронов два протона, которые мембрана черпает из цитоплазмы. Убихинол перемещается от внутренней стороны плазмолеммы к наружной и, отдавая там электроны цитохрому с, окисляется с отдачей 2Н+ и выделением их в окружающую среду. Поглощение одного фотона обеспечивает перенос одного Н+- иона через плазматическую мембрану хлорофиллсодержащей бактерии.
Так как содержание Н+ в цитоплазме выше, чем в окружающей среде система электронного транспорта в фотосинтетическом комплексе плазмолеммы хлорофиллсодержащей бактерии обеспечивает трансмембранный перенос Н+- ионов в соответствии с их концентрационным градиентом.
Пассивный транспорт протонов приводит к эффекту обращения протонной помпы, сосредоточенной также в плазмолемме. В результате Н+-зависимая АТФаза (Н-АТФаза), являющаяся главным компонентом протонного насоса, катализирует не гидролиз АТФ, а его синтез из АДФ и ортофосфата, т. е. выполняет роль АТФсинтетазы. За счет АТФ осуществляются все процессы жизнедеятельности хлорофиллсодержащей бактерии, включая поддержание ионных градиентов на ее плазматической мембране.
Такие микроорганизмы не способны синтезировать углеводы за счет работы фотосинтетического комплекса, поскольку возбужденные электроны, отдав феофитину, убихинону и цитохрому избыточную энергию, возвращаются с цитохрома с на молекулу хлорофилла:
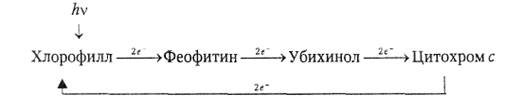
Итак, фотосинтез хлорофиллсодержащих бактерий ограничен образованием АТФ за счет реализации протонного градиента на плазматической мембране.
Дальнейшая эволюция жизни связана с появлением у зеленых растений способности использовать фотосинтез для созидания углеводов и других высокомолекулярных органических веществ. Клетки зеленых растений (аутотрофов) обеспечивают за счет фотосинтеза питательными веществами, а значит, и свободной энергией как самих себя, так и гетеротрофов.
Для синтеза углеводов электроны, возбужденные светом в хлорофилле, должны не только регулировать трансмембранный перенос Н+-ионов, но и переноситься на другие вещества, вплоть до СО2, а не возвращаться в молекулы, которым они прежде принадлежали. Поэтому цепь переноса возбужденных электронов, замкнутая у хлорофиллсодержащих 6актерий, становитсяразомкнутой у зеленых растений.
Фотосинтез у зеленых растений. Энергия фотонов преобразуется в энергию химических связей синтезируемых органических веществ:
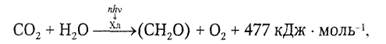
где hv — квант света, п — число фотонов, (СН2О) — фрагмент молекулы углевода
Скорость фотосинтеза измеряется количеством кислорода, выделенного за единицу времени. Она зависит от интенсивности поглощенного света. Максимальная скорость фотосинтеза при постоянном сильном освещении достигает одной молекулы О2 (на одну молекулу хлорофилла) за 50 с.
Источником всего атмосферного кислорода служит вода, участвующая в реакциях фотосинтеза. При восстановлении углекислого газа до углевода осуществляется перенос 4 атомов водорода с Н2О на СО2. Изменение свободной энергии в реакциях фотосинтеза при образовании одной молекулы О2 составляет около 500 кДж · моль-1, на что затрачивается 8 квантов света с суммарной энергией примерно 1470 кДж · моль-1.
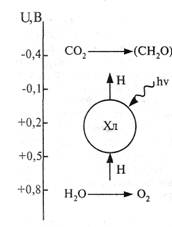
Рис. 27. Схема фотосинтеза: по оси ординат − восстановительный потенциал − U; (СН2О) − фрагмент молекулы углевода.
Следовательно, коэффициент использования солнечной энергии при фотосинтезе достигает 34%. Эта свободная энергия черпается из фотохимических процессов, в которых участвует хлорофилл. Каждая молекула хлорофилла тесно связана с донором (Д) и акцептором (А) электронов. Поэтому при ее фотовозбуждении происходят следующие превращения:
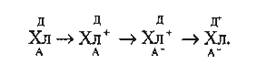
Акцептор принимает электрон от возбужденного хлорофилла и превращается в А-. Место этого электрона в хлорофилле занимает другой, принимаемый им от донора. Электрон не может перейти с донора на акцептор непосредственно, так как они пространственно разобщены и не взаимодействуют между собой. Пространственное разобщение их обеспечивается тем, что донор и акцептор являются компонентами биологической мембраны и фиксированы в ее определенных точках.
Не взаимодействуя между собой, А- и Д+, образовавшиеся под действием света при участии хлорофилла, могут участвовать в других окислительно-восстановительных реакциях с теми мембранными компонентами, которые тесно контактируют с ними. Вне биомембраны фотосинтез не осуществляется.
Местом фотосинтеза в зеленых растениях являются мембранные системы хлоропластов. В этом специализированном органоиде, кроме двойной наружной мембраны, содержится сложно организованная сеть внутренних мембран, образующих многослойные структуры, упакованные в пачки (граны). Внутренние мембраны ограничивают замкнутые объемы в виде уплощенных пузырьков − тилакоидов. В каждом хлоропласте примерно 1000 тилакоидов, а в одной клетке − от 50 до 200 хлоропластов. В мембранах тилакоидов протекают светозависимые фотосинтетические реакции, так как там сосредоточены хромофоры − молекулы, поглощающие световую энергию. К ним относятся хлорофилл а, хлорофилл b, каротиноиды и другие пигменты. Их спектры поглощения изображены на рис. 28.

Рис. 28. Спектры поглощения пигментов, присутствующих в мембране тилакоида: по оси абсцисс − длина волны (λ); по оси ординат − коэффициент поглощения (αλ); 1− хлорофилл a, 2 − хлорофилл b, 3 − каратиноиды, 4 − спектр солнечного излучения (интенсивность излучения − в отн. единицах).
Они свидетельствуют, что хлорофилл поглощает свет наиболее интенсивно в синей и красной, но отражает в зеленой и желтой областях. Этим определяется зеленый цвет растений. На 1 хлоропласт приходится примерно 109 молекул хлорофилла.
Две разновидности хлорофилла (a и b), имея незначительные различия в химическом строении, существенно отличаются по физическим свойствам и биологической активности. О коренных отличиях в механизмах переноса энергии свидетельствует наличие флуоресценции у хлорофилла а (с квантовым выходом около 0,2) при ее отсутствии у хлорофилла b. Последний сам по себе непосредственно не участвует в фотосинтетических превращениях, но он входит в состав светособирающей пигментной матрицы, помогающей улавливать солнечную энергию. После фотовозбуждения хлорофилл b быстро передает свою избыточную энергию хлорофиллу а, который при этом возбуждается и принимает непосредственное участие в фотосинтезе. Хлорофилл а может возбуждаться светом и без посредника, но участие хлорофилла b повышает коэффициент использования солнечной энергии. Он повышается также благодаря присутствию в светособирающей матрице других пигментов (каротиноидов и фикобилинов). Сопоставив спектры поглощения хлорофилла и каротиноидов (см. рис. 28), нетрудно убедиться, что хлорофилл поглощает энергию ограниченного участка солнечного спектра. Однако фотосинтез идет под действием почти всей видимой области электромагнитного спектра. Зеленый свет хорошо поглощают каротиноиды, входящие в светособирающую матрицу. Кроме того, каротиноиды защищают хлорофилл от фотоокисления при избыточном освещении.
Перенос энергии от различных пигментов этой матрицы на хлорофилл а осуществляется по резонансному механизму. В конце концов энергия фотовозбуждения достигает реакционного центра, в котором сосредоточено несколько молекул хлорофилла а, ориентированных определенным образом в тилакоидной мембране. Здесь начинается первая стадия фотохимического процесса. Совокупность реакционного центра и светособирающей матрицы называется фотосинтетической единицей. Каждая из них включает приблизительно 300 молекул хлорофилла.
Фотосинтетическая единица входит в состав фотосистемы (ФС), компонентами которой являются также интегральные белки тилакоидной мембраны.
Мембранные протеины фиксируют («заякоревают») многие молекулы хлорофилла на одной полипептидной цепи, создавая тем самым необходимую ориентировку пигмента. Комплекс «хлорофилл а − мембранный белок» служит главным узлом фотогенератора, как иногда называют фотосистему.
Функциональным элементом тилакоидной мембраны считается квантосома, в состав которой входят две фотосистемы, не одинаковые по свойствам. В каждой ФС есть собственная фотосинтетическая единица, причем относительное содержание хлорофилла а в ФС I много выше, чем в ФС II. Обе фотосистемы поглощают свет с длинами волн короче 680 нм, но только ФС I способна возбуждаться и более длинноволновым светом, причем ее максимум поглощения приходится на 700 нм. Поэтому хлорофилл а, входящий в разные фотосистемы, имеет различное наименование: в ФС I его называют пигментом Р700, а в ФС II − пигментом Р680. Различия определяются не особенностями молекулярной структуры пигментов (она одинакова), а специфическим мембранным окружением хлорофилла а в ФС I и ФС II (вероятно, составом мембранных белков, «заякоревающих» молекулы пигмента). В целом молекулярная масса квантосомы достигает 2 106 дальтон.
Между молекулами хлорофилла, принадлежащими разным ФС в одной квантосоме, расположены молекулы других веществ, входящих в ее состав и выполняющих функцию переноса электронов. Поэтому говорят, что ФС I и ФС II разобщены в пространстве тилакоидной мембраны, но сопряжены между собой системой переноса электронов, которые переносятся с ФС II на ФС I, и обратный переход невозможен.
В темноте молекула хлорофилла а пребывает на нижнем синглетном уровне. Световая энергия по резонансному механизму переводит его электроны на более высокий энергетический уровень. Полосы поглощения хлорофилла (см. рис. 28) соответствуют переходам S0 → S1* (в красной области спектра) и S0 → S2* (в синей области).
Раствор хлорофилла a in vitro флуоресцирует за счет обратного перехода электронов с S1* на S0 (рис. 29). С уровня S1* возможен также безызлучательный переход на метастабильный триплетный уровень Т. Находясь на нем, электроны хлорофилла могут перейти под действием света на уровень Т*, что означает возбужденное триплетное состояние хлорофилла. Именно такой переход присущ хлорофиллу in vivo, когда он встроен в тилакоидную мембрану. С уровня Т электроны могут возвратиться и на уровень S0, что сопровождается фотолюминесценцией. Поэтому хлорофилл а люминесцирует не только в пробирке, но и в хлоропластах. Однако его квантовый выход in vivo только 0,03−0,06, тогда как in vitro − 0,2.
Из сопоставления этих чисел ясно, что львиная доля энергии, выделяющейся при электронных переходах в облученной молекуле хлорофилла а, находящейся в тилакоидной мембране, идет на фотосинтез.
Фотосинтез осуществляется за счет перехода возбужденных электронов с Т на Т*, при котором изменяется их спин. Появление же неспаренных электронов приводит к образованию свободных радикалов. Возникновение свободных радикалов при фотосинтезе доказано методом электронного парамагнитного резонанса.
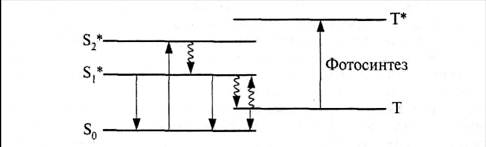
Рис. 29. Схема электронных уровней хлорофилла (по А. Красновскому).
Полный цикл фотосинтетических превращений начинается с фотовозбуждения хлорофилла а в ФС II (Р680). Возбужденный электрон переносится с Р680 на акцептор, тесно контактирующий с хлорофиллом в тилакоидной мембране. По-видимому, акцептором служит цитохром 555 (Q). На переход затрачивается энергия возбуждения электрона, так как он преодолевает восстановительный потенциал в 1,24 В (идет «в гору»).
Приняв электрон, акцептор восстанавливается, а в молекуле хлорофилла, отдавшей его, возникает дырка. Она заполняется электроном воды, которая расщепляется в процессе фотосинтеза с образованием кислорода, протонов и электронов. По-видимому, расщепление воды (точнее, ее окисление до О2) производит не сам возбужденный хлорофилл, а некое промежуточное окисленное соединение, образующееся при возбуждении Р680. Окисление воды, приводящее к выделению кислорода, катализируется ферментной системой, содержащей трехвалентный ион марганца.
Присоединив электрон, хлорофилл (Р680) восстанавливается, и к нему возвращается способность возбуждаться новыми квантами света. Кислород выделяется в атмосферу. Протоны закисляют содержимое тилакоидов, поддерживая там более высокую концентрацию Н+ по сравнению с цитозолем.
Электроны, покинувшие молекулы хлорофилла (Р680) и восстановившие вещество Q последовательно переходят от одного компонента транспортной цепи к другому в направлении более высокого положительного восстановительного потенциала («с горы») − к пластохинону и далее к пластоцианину. Свободная энергия, выделяющаяся при этом ступенчато (дискретно), запасается тилакоидной мембраной и обеспечивает синтез АТФ из АДФ и ортофосфата. Так как скорость переноса электронов по транспортной цепи ФС II не зависит от температуры, то возникло предположение о туннельном механизме миграции электронов между окислительно-восстановительными компонентами этого каскада. Последним из них в ФС II является Р700, т. е. хлорофилл а, принадлежащий другой фотосистеме (ФС I) в данной квантосоме.
Однако Р700 приобретает способность принять электроны из ФС II только после того, как сам поглотит свет, возбудится и потеряет свой электрон, который поступит в транспортную цепь ФС I. При потере электрона в молекуле Р700 возникает дырка, которую и занимает электрон, пришедший сюда из ФС II (с пластохинона). Следовательно, возбужденный хлорофилл, входящий в состав ФС II, восстанавливает пластохинон (до гидрохинона), а возбужденный хлорофилл, принадлежащий ФС I, окисляет гидрохинон до пластохинона, возвращая ему способность принимать новые электроны от Р680. Еще раз напомним, что такое сопряжение в работе двух фотосистем осуществляется в пределах одной квантосомы. В ней между молекулами хлорофилла, принадлежащими разным фотосистемам, иными словами, между Р680 и Р700, расположено примерно 5 молекул пластохинона. Пигмент Р700, приняв электроны от компонентов ФС II, восстанавливается, и к нему возвращается способность возбуждаться светом.
В ФС I пока не идентифицировано вещество с большим отрицательным восстановительным потенциалом, на которое переходят возбужденные электроны с Р700. Приняв электрон от возбужденного хлорофилла, X становится сильным восстановителем (Х-), с которого начинается второй каскад переноса электрона в сторону более высокого положительного восстановительного потенциала. Последним компонентом цепи транспорта электронов в ФС I является НАДФ+, восстанавливаемый до НАДФ·Н. Донором водорода служит вода, расщепившаяся под действием света при участии хлорофилла (Р680) еще на первой стадии фотосинтеза.
Конечным акцептором электронов, прошедших последовательно ФС II и ФС I, является СО2. Перенос на него электронов с редокс-пары НАДФ+/НАДФ·Н (восстановительный потенциал равен -0,324 В) осуществляется сложной ферментной системой, входящей в так называемый цикл Кальвина − последовательность химических реакций, протекающих в 13 стадий (рис. 30). Энергия, выделяемая при транспорте электронов с названной редокс-пары на СО2, недостаточна для его восстановления до углеводов. Дополнительная энергия, необходимая для синтеза углеводов, поступает в цикл Кальвина в форме АТФ. Так, образование одной молекулы гексозы из 6 молекул СО2 обеспечивается не только переносом электронов с НАДФ · Н на СО2, но еще и 18 молекулами АТФ. Этот макроэрг образуется также в реакциях фотосинтеза посредством преобразования солнечной энергии, поглощенной хлорофиллом. Синтезу АТФ служит транспорт в квантосоме (в ФС II и ФС I) до этапа восстановления НАДФ+.
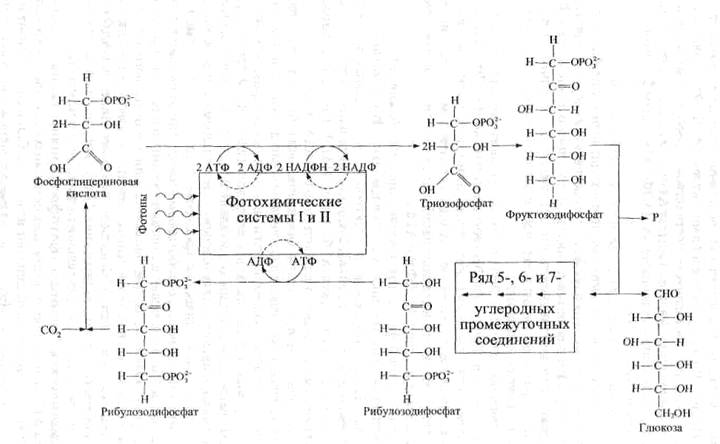 |
Рис. 30. Связь между фотосистемами и циклом Кальвина.
За счет поглощения двух квантов света двумя молекулами хлорофилла (Р680 и Р700), принадлежащими одной квантосоме, происходит перенос одного электрона на СО2. Кроме того, энергия этих двух фотонов обеспечивает перенос одного электрона с воды на Р680. Рассматривая процессы электронного транспорта в ФС II и ОС I в совокупности, можно заключить, что поглощение двух квантов света двумя молекулами хлорофилла приводит к переносу одного электрона с Н2О на СО2, из которого синтезируются углеводы.
В ходе двухтактного (в ФС II и ФС I) фотоэлектронного преобразования возникают молекулярный кислород, НАДФН (восстановленный НАДФ), а также АТФ. Это единственная, хотя и сложная (многоступенчатая) световая реакция в процессе фотосинтеза. Дальнейшие аутотрофные биосинтетические реакции не нуждаются в свете. Они происходят в зеленых растениях за счет энергии, заключенной в электронах, принадлежащих НАДФН и АТФ.
Лучше других реакций фотосинтеза изучен процесс образования шестиуглеродной молекулы глюкозы из 6 молекул СО2 и 6 молекул Н2О (реакция фиксации углекислого газа). 12 пар возбужденных электронов, необходимых для осуществления этой реакции, поступают от НАДФН. Дополнительным поставщиком свободной энергии служат 18 молекул АТФ. Вклад НАДФН и АТФ в фотосинтез одного моля глюкозы составляет соответственно 660 и 252 ккал.
Аналогично углеводам происходит фотосинтез всех биологически важных макромолекул, И здесь нужно еще раз подчеркнуть, что для созидания углеводов, белков, жиров, нуклеиновых кислот и других высокомолекулярных органических соединений из двуокиси углерода, воды, нитратов, сульфатов и прочих сравнительно простых веществ необходим колоссальный приток электронов к ним.
Углеводы, белки, жиры служат основными питательными веществами для гетеротрофов. В ходе катаболических процессов, также обеспечиваемых электрон-транспортными системами, освобождаются электроны примерно в таком же количестве, в каком они захватывались органическими веществами при их фотосинтезе. Электроны, освобождающиеся при катаболизме, переносятся на молекулярный кислород дыхательной цепью митохондрий. Здесь окисление сопряжено с фосфорилированием − синтезом АТФ посредством присоединения к АДФ остатка фосфорной кислоты (т. е. фосфорилирования АДФ). Этим обеспечивается энергоснабжение всех процессов жизнедеятельности животных и человека.
Химиоосмотическая гипотеза фотофосфорилирования. Разложение воды и синтез АТФ происходят на свету. Для остальных реакций, в ходе которых фотосинтетические комплексы поглощают из воздуха СО2 и синтезируют из него углеводы, свет не требуется. Поэтому их называют темповыми реакциями. Они обеспечиваются свободной энергией, запасенной в световую фазу (стадию).
Фотофосфорилированием называют синтез АТФ из АДФ и ортофосфата, происходящий под действием света в мембранах, содержащих хлорофилл. Катализатором фотосинтеза АТФ служит ферментная система, образующая протонный насос, который наряду с квантосомой сосредоточен в тилакоидной мембране. Эта ферментная система (Н-зависимая АТФаза) сопрягает электронный транспорт в квантосоме с конвертированием свободной энергии в концевой фосфатной связи АТФ. Поэтому ее называют сопрягающим фактором (CF). В этом сопряжении участвует также концентрационный градиент Н+-ионов (протонный градиент) на тилакоидной мембране. Энергия, переносимая возбужденными электронами по квантосоме, отчасти расходуется на создание и поддержание протонного градиента посредством расщепления воды внутри тилакоида, где всегда рН ниже, чем в цитозоле (рис. 31).
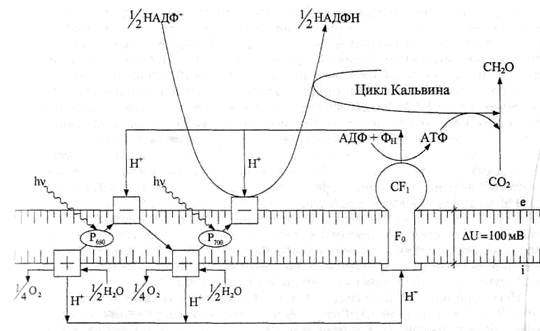
Рис. 31. Схема механизма фотофосфорилирования.
Как полагают, протонный градиент на тилакоидной мембране поддерживается и посредством работы протонного насоса, который в темноте обеспечивает активный транспорт Н+-ионов через нее. Источником энергии для переноса Н+ из цитозоля в тилакоид служит АТФ, гидролиз которого активируется Н-АТФазой. В свою очередь, протонный градиент на тилакоидной мембране является движущей силой пассивного транспорта Н+ через нее. При таком движении протонов Н-АТФаза катализирует не гидролиз АТФ, а синтез его из АДФ и ортофосфата, т. е. служит АТФсинтетазой. Происходит обращение протонной помпы. Следовательно, энергия протонного градиента является промежуточной формой преобразования солнечной энергии в химическую энергию макроэргических связей АТФ.
Существование протонного градиента на тилакоидной мембране подтверждено прямыми измерениями. При длительном освещении зеленых растений рН внутри тилакоидов становится на 3,5 единицы ниже, чем в цитозоле. В обычных условиях на свету эта разница меньше, но существует всегда. Транспорт одного электрона по обеим фотосистемам (ФС II и ФС I), принадлежащим одной квантосоме, приводит к образованию внутри тилакоида одного протона. Следовательно, протонный градиент на тилакоидной мембране непосредственно обеспечивается энергией, освобождающейся при переносе возбужденных электронов между ее молекулярными компонентами.
За счет протонного градиента на мембране тилакоида поддерживается разность потенциалов (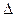 U) порядка 100 мВ. Именно электрическая энергия, заключенная в разности потенциалов на тилакоидной мембране (как в конденсаторе), видимо, является промежуточной формой преобразования свободной энергии при фотосинтезе: солнечная энергия
U) порядка 100 мВ. Именно электрическая энергия, заключенная в разности потенциалов на тилакоидной мембране (как в конденсаторе), видимо, является промежуточной формой преобразования свободной энергии при фотосинтезе: солнечная энергия 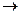 энергия возбужденных электронов
энергия возбужденных электронов 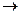 электрическая энергия на тилакоидной мембране
электрическая энергия на тилакоидной мембране 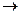 химическая энергия макроэргических связей АТФ. Однако электрическую энергию мембраны, обусловленную разобщением Н+-ионов и анионов на ней, можно рассматривать как эквивалент осмотической энергии, заключенной в концентрационном градиенте протонов. Это, по существу, эквивалентные понятия. Поэтому промежуточную форму энергетических преобразований при фотофосфорилировании можно называть и осмотической энергией протонного градиента, как было сказано выше. Поэтому гипотеза называется химиоосмотической.
химическая энергия макроэргических связей АТФ. Однако электрическую энергию мембраны, обусловленную разобщением Н+-ионов и анионов на ней, можно рассматривать как эквивалент осмотической энергии, заключенной в концентрационном градиенте протонов. Это, по существу, эквивалентные понятия. Поэтому промежуточную форму энергетических преобразований при фотофосфорилировании можно называть и осмотической энергией протонного градиента, как было сказано выше. Поэтому гипотеза называется химиоосмотической.
При падении 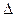 U на тилакоидной мембране синтез АТФ угнетается, а при увеличении − усиливается. Другим подтверждением участия протонного градиента в образовании макроэрга является возможность синтеза АТФ в темноте, если на тилакоидной мембране создается и поддерживается градиент Н+-ионов путем искусственного защелачивания среды вокруг тилакоида.
U на тилакоидной мембране синтез АТФ угнетается, а при увеличении − усиливается. Другим подтверждением участия протонного градиента в образовании макроэрга является возможность синтеза АТФ в темноте, если на тилакоидной мембране создается и поддерживается градиент Н+-ионов путем искусственного защелачивания среды вокруг тилакоида.
 2014-01-31
2014-01-31 1611
1611
