Соотношения между активностями, определенными по отношению к различным стандартным состояниям, можно получить следующим образом.
Рассмотрим два стандартных состояния растворенного вещества В в растворе А–В:
– состояние чистого компонента;
– состояние в 1-%-ном идеальном растворе.
Активности вещества В при данном выборе стандартных состояний
 (1)
(1)
Учитывая, что в бинарном растворе А–В
 (2)
(2)
где М А и М В – молярные массы растворителя А и растворенного вещества В, получим
 (3)
(3)
Для разбавленных растворов (при [%B] = 0 или x B = 0 и x А = 1) коэффициенты активности равны f B = 1, а  .
.
Тогда  (3а)
(3а)
и из выражения (3) получаем  , (4)
, (4)
где 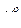 – предельное значение коэффициента активности при x B → 0
– предельное значение коэффициента активности при x B → 0
или  .
.
Выражение (4) можно преобразовать, приведя к виду:  . (4а)
. (4а)
Замена мольных долей x B и x А массовыми %% посредством выражения
 (5)
(5)
и подстановка (5) в (4) или, лучше, в (3) с учетом (3а) приводит к другому выражению
 . (6)
. (6)
Таблица
Предельные коэффициенты активности 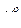 элементов в жидком железе при 1873 К
элементов в жидком железе при 1873 К
| элемент | Pb | Ag | Cu | Cr | Mo | Ti | Al | Si |
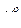
| 1400 | 200 | 8,6 | 1,0 | 1,0 | 0,037 | 0,029 | 0,0013 |
Из таблицы следует:
– Cr, Mo и др., для которых  , образуют с Fe идеальные растворы;
, образуют с Fe идеальные растворы;
– Ag, Cu, Pb и др., для которых  , оказываются ограниченно растворимыми в Fe (при больших значениях активности стремятся покинуть раствор);
, оказываются ограниченно растворимыми в Fe (при больших значениях активности стремятся покинуть раствор);
– Al, Ti, Si и др., для которых  , образуют с Fe прочные связи и соединения в растворе.
, образуют с Fe прочные связи и соединения в растворе.
Пример 1. Зависимость коэффициента активности углерода в расплаве Fe – С от концентрации углерода для интервала температур 1550…16000С имеет вид: lg gC = – 0,21 + 4,3 x C
Рассчитайте значения коэффициентов активности углерода по отношению к стандартному состоянию – 1-%-ный раствор для интервала концентраций углерода 0,1…1,5% (мас.). Предельный коэффициент активности углерода в железе равен  .
.
Решение.
При некоторых выбранных значениях [%C] для интервала концентраций углерода 0,1…1,5% вычисляем мольные доли углерода x C в расплаве Fe – С и коэффициенты активности углерода gC и f С по следующим выражениям:
 ,
,
lg gC = – 0,21 + 4,3 x C;

Результаты расчета заносим в таблицу.
| [%C] | 0,1 | 0,5 | 1,0 | 1,2 | 1,5 |
| x C | 0,0046 | 0,0228 | 0,0449 | 0,0535 | 0,0662 |
| gC | 0,646 | 0,773 | 0,962 | 1,047 | 1,187 |
| f С | 1,128 | 1,331 | 1,628 | 1,760 | 1,975 |

| 0,0030 | 0,0176 | 0,0432 | 0,0560 | 0,0785 |
 ,% ,%
| 0,113 | 0,665 | 1,63 | 2,11 | 2,96 |
Результаты вычислений показывают:
–является реальным раствором;
– активности и коэффициенты активности углерода в расплаве Fe – С, определенные по отношению к различным стандартным состояниям, существенно различаются.
Пример 2. Чистый никель расплавляют и выдерживают в тигле из SiO2 при температуре 16000С в атмосфере Н2– Н2О (75% Н2 и 25% Н2О). Общее давление в тигле равно 1 атм. Определить содержание кремния в никеле за счет восстановления его из материала тигля (SiO2) к моменту установления равновесия в системе.
Решение.
Записываем уравнение реакции взаимодействия газовой смеси с SiO2 тигля, которая приводит к восстановлению кремния и растворению его в никеле: SiO2 + 2Н2 = [Si] + 2Н2О (1)
Константа равновесия реакции имеет вид: 
Для определения константы равновесия реакции (1) представим ее как сумму двух реакций
Н2 + ½ О2 = Н2О (2)  – 246115 + 54,12 Т, Дж
– 246115 + 54,12 Т, Дж
Si + О2 = SiO2 (3)  = – 906442 + 175,64 Т, Дж
= – 906442 + 175,64 Т, Дж
Тогда 
Из выражения 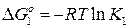 находим значение константы равновесия реакции (1) при 1600оС (1873К). Она равна К1 = 9,33∙10–9.
находим значение константы равновесия реакции (1) при 1600оС (1873К). Она равна К1 = 9,33∙10–9.
Из выражения для К1 находим активность кремния в никеле

В разбавленном растворе  (табличное значение)
(табличное значение) 
Тогда 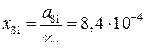
Пересчет на массовый %Si по уравнению  дает содержание кремния в никеле, равное 0,04%(мас.)
дает содержание кремния в никеле, равное 0,04%(мас.)
 2020-01-14
2020-01-14 375
375








